Химическое сродство – способность реагирующих веществ образовывать новые соединения. Причинами, вызывающими химическое сродство, являются межатомные взаимодействия.
Значение химического сродства одних элементов по отношению к другим позволяет оценить характер взаимодействия различных веществ при сварке. Особенно значимы данные о сродстве элементов к кислороду. Существуют три основных способа оценки сродства элементов к кислороду:
– по тепловому эффекту реакции окисления;
– изменению изобарно-изотермического потенциала образованию окислов;
– упругости диссоциации окислов.
Оценка степени сродства элементов к кислороду по тепловому эффекту реакции. Степень сродства различных элементов к кислороду по тепловому эффекту реакции окисления оценивается при взаимодействии газообразного кислорода и вещества с образованием продуктов реакции в конденсированном виде, т.е. в жидком или твёрдом состоянии.
В этом случае тепловой эффект относится к одной граммолекуле кислорода, принимавшего участие в реакции. Такие реакции и их тепловые эффекты можно сравнивать между собой, и при этом чем больше значение теплового эффекта реакции, тем больше сродство реагирующих веществ к кислороду. Так, реакции:
Ti + O2 = TiO2 + 219 ккал/(г×моль); Si + O2 = SiO2 + 206 ккал/(г×моль);
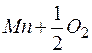 = MnO +186,2 ккал/(г×моль);
= MnO +186,2 ккал/(г×моль);
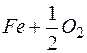 = FeO +129,0 ккал/(г×моль).
= FeO +129,0 ккал/(г×моль).
определяют следующий ряд элементов по увеличивающемуся сродству к кислороду: Fe, Mn, Si, Ti.
Оценка степени сродства к кислороду по изменению изобарно-изотермического потенциала. При наличии в системе газовой фазы кислорода направление протекания процессов определяется изменением изобарно-изотермического потенциала.
Если в реакции изобарно-изотермический потенциал уменьшается, процесс самопроизвольно развивается в направлении окисления; если этот потенциал увеличивается, значит самопроизвольное окисление невозможно, значение потенциала равно нулю, что отвечает состоянию равновесия. Чем меньше по своему значению изобарно-изотермический потенциал, тем больше сродство элемента к кислороду в этом окисле.
Оценка степени сродства элементов к кислороду по упругости диссоциации окислов. В сварочной металлургии наиболее распространена оценка степени сродства элементов к кислороду по упругости диссоциации окислов. В общем виде реакция окисления элемента с образованием конденсированного окисла определяется как:
2 MeO = 2 Me + O 2.
Константа равновесия этой реакции
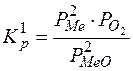 .
.
Так как значение парциального давления (упругость паров) не зависит от концентрации вещества, находящегося в конденсированном виде, и является величиной постоянной:
PMe = const; PMeO = const, то имеем KP = Pо 2.
Величина Ро 2 – давление свободного кислорода, необходимое для образования окисла данного элемента и отвечающее состоянию равновесия данной реакции называют упругостью диссоциации данного окисла MeO. Таким образом, упругость диссоциации химического соединения есть концентрация (давление) газообразного компонента (кислорода) в равновесной системе, выраженная в атмосферах.
Чем меньше значение упругости диссоциации химического соединения – окисла, тем прочнее этот окисел.
Поскольку давление свободного кислорода для образования окисла очень мало, то пользуются значением логарифма давления, т.е. lg Po 2, который определяется как:
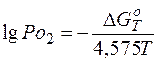 .
.
Чтобы определить, в каком направлении может протекать реакция образования окисла, следует сопоставить расчётное значение lg Po с логарифмом действительного парциального значения давления кислорода при протекании реакции (в нашем случае – атмосферное, т.е. Po 2).
Возможны три соотношения этих величин:
а) lg Po 2 = lg [ Po 2] – реакция находится в состоянии равновесия;
б) lg Po 2 > lg [ Po 2] – наблюдается восстановление элемента из окисла;
в) lg Po 2 < lg [ Po 2] – наблюдается окисление элемента кислородом и тем энергичнее, чем больше разность lg Po 2 – lg [ Po 2].
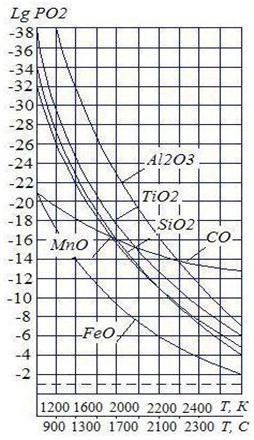 Рис. 5. Изменение упругости диссоциации окисла от температуры Рис. 5. Изменение упругости диссоциации окисла от температуры | На рис. 5 показано изменение упругости диссоциации различных окислов в зависимости от температуры. Из графика видно: 1. Все кривые, выражающие зависимость упругости диссоциации окислов и температуры, расположены выше прямой, отвечающей парциальному давлению воздуха. Это означает, что в рассматриваемом интервале температур металлы существуют устойчиво в виде окислов. 2. Чем выше расположена кривая упругости диссоциации окисла, тем прочнее окисел и тем более сильным раскислителем будет элемент, образовавший с кислородом окисел. |
3. С увеличением температуры значения упругости диссоциации окислов увеличиваются, следовательно стойкость существования окислов уменьшается (т.е. сродство к кислороду уменьшается); окислы становятся менее прочными.
При больших температурах значения упругости диссоциации окислов элементов выравниваются между собой по сравнению со значениями при низких температурах. Так, при Т = 2400 °С разница между значениями упругости диссоциации железа Si и Mn соответственно 3,62 и 3,82, а при Т = 1500 °С соответственно 7,18 и 5,98. Таким образом, наибольший эффект раскисления Si и Mn проявляется в низкотемпературной части сварочной ванны.
4. В отличие от Si, Mn и других раскислителей углерод с уменьшением температуры теряет раскисляющую способность, а при высоких температурах углерод является самым сильным раскислителем.
 2015-04-01
2015-04-01 8350
8350








