Неконкурентный ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу с одинаковой эффективностью. Ингибитор вызывает такие конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату.
Схема и уравнение Михаэлиса-Ментен в случае неконкурентного ингибирования:
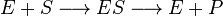  
|
Бесконкурентное ингибирование [править | править вики-текст]
При бесконкурентном ингибировании ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом. Субстрат, связываясь с ферментом, изменяет его конформацию, что делает возможным связывание с ингибитором. Ингибитор, в свою очередь, так меняет конформацию фермента, что катализ становится невозможным.
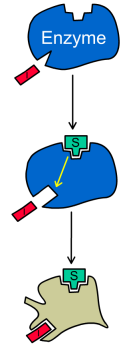 |
 Схема и уравнение Михаэлиса-Ментен в случае бесконкурентного ингибирования:
Схема и уравнение Михаэлиса-Ментен в случае бесконкурентного ингибирования:
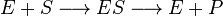
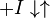
|
Ингибирование субстратом[править | править вики-текст]
Ингибирование субстратом — частный случай бесконкурентного ингибирования, когда две молекулы субстрата связываются с ферментом, что препятствует образованию продукта.
Схема и уравнение Михаэлиса-Ментен в случае ингибирования субстратом:
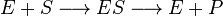
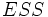
|
Необратимое ингибирование[править | править вики-текст]
Формирование стабильного комплекса ингибитора с ферментом, ведущее к его необратимой инактивации. Случай необратимого ингибирования можно обнаружить по тому признаку, что при разбавлении раствора не происходит повышения удельной активности фермента, как в случае обратимого ингибирования
Аллостерическое ингибирование[править | править вики-текст]
Аллостерические ингибиторы связываются с отдельными участками фермента вне активного центра. Такое связывание влечет за собой конформационные изменения в молекуле фермента, которые приводят к уменьшению его активности. Аллостерические эффекты встречаются практически только в случае олигомерных ферментов. Кинетику таких систем нельзя описать с помощью простой модели Михаэлиса-Ментен.
4. 2,3-Бифосфоглицерат - аллостертеский регулятор сродства гемоглобина к О2
2,3-Бифосфоглицерат (БФГ) - вещество, синтезируемое в эритроцитах из промежуточного продукта окисления глюкозы 1,3-бифосфоглицерата.
В нормальньж условиях 2,3-бифосфоглицерат присутствует в эритроцитах примерно в той же концентрации, что и гемоглобин. БФГ, присоединяясь к гемоглобину, также может менять его сродство к О2.
В центре тетрамерной молекулы гемоглобина есть полость, образованная аминокислотными остатками всех четырёх протомеров.
Центральная полость - место присоединения БФГ.
Размеры центральной полости могут меняться: отщепление О2 от оксигемоглобина вызывает его конформационные изменения, которые способствуют образованию дополнительных ионных связей между димерами α 1 β 1 и α 2 β 2. В результате пространственная структура дезоксигемоглобина становится более жёсткой, напряжённой, а центральная полость расширяется.
В расширенную полость дезоксигемоглобина БФГ, имеющий сильный отрицательный заряд, присоединяется с помощью ионных связей, образующихся с положительно заряженными функциональными группами двух β -цепей гемоглобина. Присоединение БФГ ещё сильнее стабилизирует жёсткую структуру дезоксигемоглобина и снижает сродство белка к О2. Присоединение БФГ к дезоксигемоглобину происходит в аллостерическом центре.
В лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина. Разрыв
ионных связей между димерами α 1 β 1 и α 2 β 2 приводит к "расслаблению" белковой молекулы, уменьшению центральной полости и вытеснению БФГ.
СМ В УЧЕБНИКЕ ГРАФИЧЕСКОЕ ПОЯСНЕНИЕ
 2015-04-30
2015-04-30 1063
1063
