1. 1. Протеиногенные аминокислоты
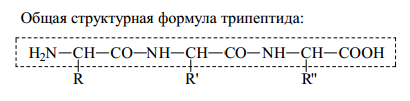
Структурными блоками или мономерами белков служат α-аминокислоты L-ряда (см. табл. 4). Общая формула α-аминокислот имеет следующий вид:
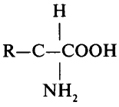
Выделенное звено формулы α-аминокислоты является неизменным для всех протеиногенных аминокислот, его можно назвать аминокислотным блоком. Аминокислоты различаются по структуре бокового радикала (R), а следовательно, и по физико-химическим свойствам, присущим этим радикалам.
По кислотно-основным свойствам аминокислоты делят в зависимости от физико-химических свойств бокового радикала на три группы: кислые, основные и нейтральные.
К кислым относятся аминокислоты с карбоксильными группами в боковом радикале: аспарагиновая и глутаминовая кислоты. К основным относятся аминокислоты лизин, аргинин и гистидин, имеющие в боковом радикале группировку с основными свойствами: аминогруппу, гуанидиновую и имидазольную группы. Все остальные аминокислоты - нейтральные, так как их боковой радикал не проявляет ни кислых, ни основных свойств.
Следовательно, аминокислоты имеют суммарный нулевой, положительный или отрицательный заряд, зависящий от рН-среды. Значение рН-среды, при котором заряд аминокислоты равен нулю, называется изоэлектрической точкой. Изоэлектрическая точка отражает кислотно-основные свойства разных групп в аминокислотах и является одной из важных констант, характеризующих аминокислоту.
По биологическому значению аминокислоты подразделяются на заменимые, полузаменимые и незаменимые.
Заменимые аминокислоты синтезируются в организме человека в достаточном количестве. К ним относятся глицин, аланин, серин, цистеин, тирозин, аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин.
Полузаменимые аминокислоты образуются в организме, но в недостаточном количестве, поэтому их недостаток должен восполняться белковой пищей. Для организма человека такими аминокислотами являются тирозин, аргинин, гистидин.
Незаменимые аминокислоты в организме человека не синтезируются, поэтому они должны поступать с пищей. Незаменимых аминокислот восемь: валин, лейцин, изолейцин, треонин, лизин, метионин, фенилаланин, триптофан.
Аминокислотный состав белков определяется не доступностью или незаменимостью той или иной аминокислоты, а назначением белка, его биологической функцией. В настоящее время определен аминокислотный состав многих сотен белков.
Примерами олигомерных белков могут служить эритроцитарный белок гемоглобин, фермент фосфофруктокиназа и многие другие.
Более подробно структурная организация и функционирование олигомерных белков будут рассмотрены в следующей теме на примере гемоглобина (рисунок 2.3).
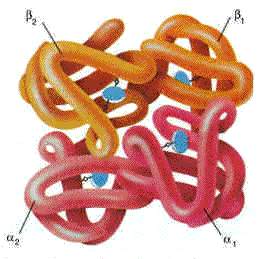
Рисунок 2.3. Пространственное строение гемоглобина. В состав его молекулы входят четыре попарно одинаковые субъединицы, обозначаемые буквами α и β. Небелковая часть гемоглобина — гем — показана синим цветом.
2. Буферные системы, буферные растворы, буферные смеси, системы, поддерживающие определённуюконцентрацию ионов водорода Н+, то есть определённую кислотность среды. Кислотность буферных растворов почти не изменяется при их разбавлении или при добавлении к ним некоторых количеств кислот или оснований.
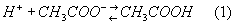
|
СОСТАВ БУФФЕРНЫХ СИСТЕМ
Буферные системы, буферные растворы, буферные смеси, системы, поддерживающие определённуюконцентрацию ионов водорода Н+, то есть определённую кислотность среды. Кислотность буферных растворов почти не изменяется при их разбавлении или при добавлении к ним некоторых количеств кислот или оснований.
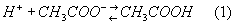
|
Определение рН и буферной емкости ацетатной буферной системы
Например, ацетатный буферный раствор (CH3COO-, CH3COOH) или гидрокарбонатный буферный раствор (HCO3-, H2CO3). рН кислотной буферной системы можно рассчитать по уравнению: pH = - lg H + [ ] C кислоты, С соли C = - lg K A - lg кислоты C соли [H ] = K + A × (2.11) где КА – константа диссоциации слабой кислоты. Изучение влияния разбавления и добавления сильных кислот и щелочей на рН этих систем.
СМ В УЧЕБНИКЕ
· 3. Регуляция каталитической активности ферментов ассоциацией/диссоциацией протомеров Протеинкиназы - группа ферментов, катализирующих перенос остатка фосфорной кислоты с АТФ на специфические ОН-группы аминокислотных остатков белков (вызывают фосфорилирование белков). Механизмы активации различных протеинкиназ неодинаковы. В качестве примера регуляции каталитической активности ферментов ассоциацией или диссоциацией протомеров можно привести регуляцию активности фермента Протеинкиназы А.
o Протеинкиназа А (цАМФ-зависимая) состоит из 4 субъединиц 2 типов: 2 регуляторных (R) и 2 каталитических (С). Такой тетрамер не обладает каталитической активностью. Регуляторные субъединицы имеют участки связывания для циклического 3',5'-АМФ (цАМФ), по 2 на каждую субъединицу. Присоединение 4 молекул цАМФ к 2 регуляторным субъединицам приводит к изменению конфор-мации регуляторных протомеров и к диссоциации тетрамерного комплекса, при этом высвобождаются 2 активные каталитические субъединицы (рис. 2-32). Такой механизм регуляции обратим. Отщепление молекул цАМФ от регуляторных субъединиц приведёт к ассоциации регуляторных и каталитических субъединиц Протеинкиназы А с образованием неактивного комплекса.
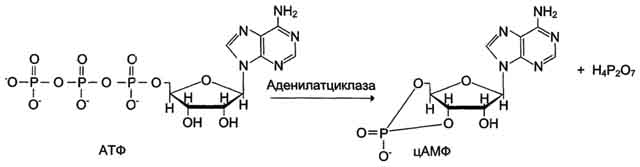
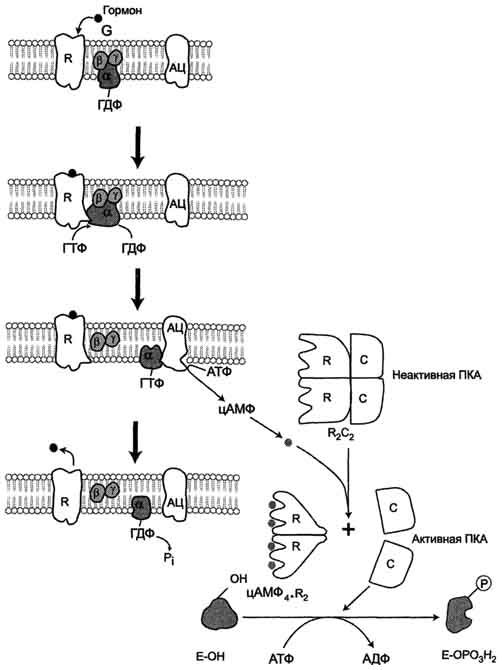
Рис. 2-32. Регуляция активности аденилатциклазы. Гормон (Г), взаимодействуя с рецептором (R) на поверхности клеток, приводит к уменьшению сродства ГТФ-связывающего белка (G-белка, состоящего из протомеров α, β, γ) к ГТФ и увеличению сродства к ГТФ. Присоединение молекулы ГТФ к активному центру G-белка вызывает диссоциацию комплекса на субъединицы α-ГТФ и димер βγ. Комплекс α-ГТФ активирует аденилатциклазу, что способствует синтезу из АТФ внутриклеточных регуляторных молекул цАМФ. АЦ - аденилатциклаза, ПКА - протеинкиназа А, Рi - Н3РО4.
 4.
4.
 2015-04-30
2015-04-30 2219
2219
