Классификация
 1. В зависимости от положения аминогруппы
1. В зависимости от положения аминогруппы
Выделяют a, b, g и другие аминокислоты. Для организма млекопитающих наиболее характерны a‑аминокислоты.
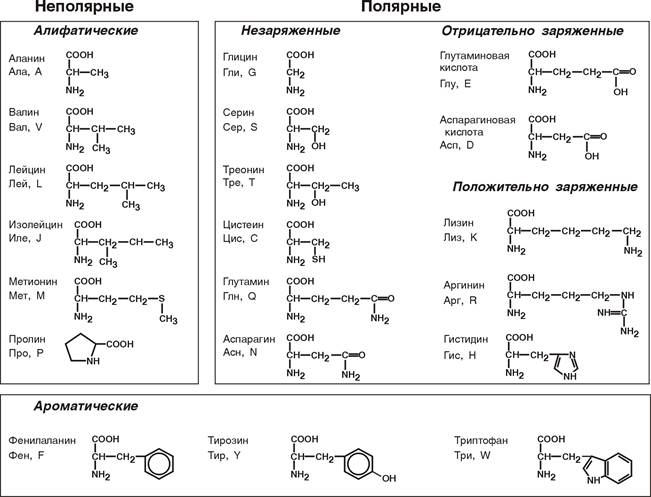
2. Для медиков наиболее интересна классификация по участию аминокислот в синтезе белков: протеиногенные (20 АК) и непротеиногенные (около 40 АК).
На примере протеиногенных аминокислот можно показать дополнительные способы классификации:
по строению бокового радикала – неполярные (алифатические, ароматические) и полярные (незаряженные, отрицательно и положительно заряженные);
электрохимическая – по кислотно-основным свойствам подразделяют нейтральные (большинство), кислые (Асп, Глу) и основные (Лиз, Арг, Гис) аминокислоты.
физиологическая классификация – по необходимости для организма выделяют незаменимые (Лей, Иле, Вал, Фен, Три, Тре, Лиз, Мет) и заменимые. Две аминокислоты являются условно незаменимыми (Арг. Гис)
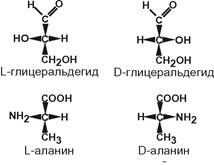
 3. По абсолютной конфигурации молекулы – D- и L-формы.
3. По абсолютной конфигурации молекулы – D- и L-формы.
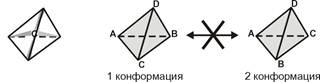
Различия связаны со взаимным расположением четырех замещающих групп, находящихся в вершинах воображаемого тетраэдра. Как известно, тетраэдр – это довольно жесткая структура, в которой невозможно произвольным образом передвинуть вершины. Точно так же для молекул, построенных на основе атома углерода. За эталон конфигурации принята структура молекулы глицеральдегида, установленная с помощью рентгеноструктурного анализа. Принято, что в качестве маркера используют наиболее сильно окисленный атом углерода, связанный с асимметричным атомом углерода (на схемах его располагают сверху). Таким атомом в молекуле глицеральдегида служит альдегидная группа, для аланина маркерной является СООН‑группа. Атом водорода располагают так же, как в глицеральдегиде.
Интересно, что в дентине, белке зубной эмали, скорость рацемизации L‑аспартата равна 0,10% в год. При формировании зуба у детей используется только L‑аспартат. Это позволяет определять возраст долгожителей в сомнительных случаях. Для ископаемых останков наряду с радиоизотопным методом также используют определение рацемизации аминокислот в белке.
В белке любого организма содержится только один изомер, для млекопитающих это L‑аминокислоты. Однако оптические изомеры претерпевают самопроизвольную неферментативную рацемизацию, т.е. L-форма переходит в D-форму. Это обстоятельство используется для определения возраста ткани.
 4. По оптической активности – право- и левовращающие.
4. По оптической активности – право- и левовращающие.
Наличие ассиметричного атома С (хирального центра) делает возможным только два расположения химических групп вокруг него. Это приводит к особому отличию веществ друг от друга, а именно – изменению направления вращения плоскости поляризации поляризованного света, проходящего через раствор. Величину угла поворота определяют при помощи поляриметра. В соответствии с углом поворота выделяют правовращающие (+) и левовращающие (–) изомеры.
Деление на L- и D-формы не соответствует делению на право- и левовращающие. Для одних аминокислот L‑формы (или D‑формы) являются правовращающими, для других – левовращающими. Например, L‑аланин – правовращающий, а L‑фенилаланин – левовращающий. При смешивании L- и D-форм одной аминокислоты образуется рацемическая смесь, не обладающая оптической активностью.
 |
Дополнение
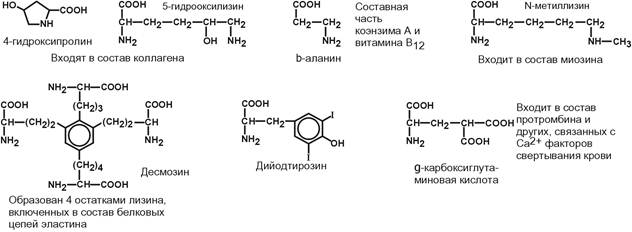
Кроме указанных, существуют и другие аминокислоты, обнаруживаемые в составе белков. В процессе синтеза белков они не участвуют, а синтезируются из протеиногенных аминокислот, уже находящихся в составе белковой цепи. Это нестандартные аминокислоты.
Физико-химические свойства
аминокислот
 1. Являются амфотерными электролитами.
1. Являются амфотерными электролитами.
Аминокислоты сочетают в себе свойства и кислот и оснований. Соответственно, в водном растворе аминокислоты ведут себя как кислоты – доноры протонов и как основания – акцепторы протонов.
Если общий заряд аминокислоты равен 0, то это ее состояние называют изоэлектрическим. Величина рН, при которой заряд аминокислоты равен 0, называется изоэлектрической точкой (pI).
рI большинства аминокислот располагается в диапазоне рН от 5,5 (Фен) до 6,3 (Про).
рI кислых аминокислот – рIГлу 3,2, рIАсп 2,8
рI основных аминокислот – рIГис 7,6, рIАрг 10,8, рIЛиз 9,7
рI гистидина позволяет ему использоваться в буферной системе гемоглобина, в котором он содержится в большом количестве. Гемоглобин легко принимает и легко отдает протоны водорода при малейших сдвигах физиологической рН крови (в норме 7,35-7,45).
2. Заряд аминокислот зависит от величины рН среды.
Отправным пунктом для понимания причин появления заряда у аминокислот является величина изоэлектрической точки. Ситуация различается для нейтральных, кислых и основных аминокислот.
Для нейтральных аминокислот: 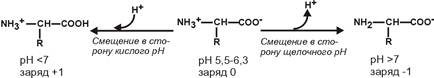
Для кислых аминокислот:
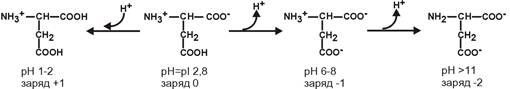
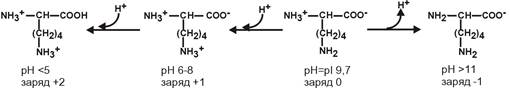
Для основных аминокислот:
Глутаминовая кислота – является предшественником g‑аминомасляной кислоты (ГАМК), являющейся тормозным медиатором нервной системы. Сам глутамат является нейромедиаторной аминокислотой, стимулирующей передачу возбуждения в синапсах ЦНС. Кроме этого, глутамат участвует в обезвреживании аммиака, синтезе пуриновх и пиримидиновых оснований, играет ведущую роль в обмене других аминокислот.
Метионин, незаменимая кислота, содержит мобильную метильную группу, которая может передаваться на другие соединения. Благодаря этому она участвует в синтезе холина, фосфолипидов, обмене витаминов В12 и фолиевой кислоты. В реакциях биосинтеза белка метионин является инициирующей аминокислотой, участвует в процессах обезвреживания токсинов в печени.
Метионин и его аналоги используют для профилактики заболеваний печени как липотропный фактор, препятствующий накоплению жира, при токсических поражениях, циррозе, атеросклерозе.
Глицин является медиатором ЦНС тормозного действия. Улучшает метаболизм в тканях мозга. Оказывает успокаивающее действие. Нормализует сон, уменьшает повышенную раздражительность. депрессивные состояния.
Гистидин – условно незаменимая аминокислота. Используется при лечении гепатитов, язв желудка и двенадцатиперстной кишки.
Цистеин участвует в метаболизме хрусталика глаза, нарушения хрусталика связаны с недостатком цистеина. Поэтому его применяют на начальных стадиях катаракты.
Вицеин – комплексный препарат глутаминовой кислоты, цистеина и глицина. Используют в виде глазных капель.
Церебролизин – гидролизат вещества мозга свиньи, содержащий низкомолекулярные пептиды (15%) и аминокислоты (85%). Используется при нарушениях функций ЦНС, мозговых травмах, кровоизлияниях, вегетативных дистониях и т.п.
Препараты для парентерального питания: полиамин (набор 13 аминокислот), вамин (набор 18 аминокислот), ваминолакт (набор 18 аминокислот, соответствующих составу грудного молока), гидролизин (гидролизат белков крови крупного рогатого скота), аминотроф (гидролизат казеина), фибриносол (гидролизат фибрина крови).
 2014-02-03
2014-02-03 9628
9628
