DG = DGV + DGW,
где DGV и DGW – объёмная и поверхностная составляющие общего изменения энергии Гиббса.
Значения DGV и DGW определяются как
DGV = 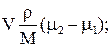
DGW = S×s,
где V и S – объём и поверхность зародыша новой фазы, r и М – плотность и молекулярная масса новой фазы, s – поверхностное натяжение, m2 и m1 – химические потенциалы соединения АВ в новой и старой фазе.
Если считать, что зародыш новой фазы сферический с радиусом r, то общее изменение энергии Гиббса определится как
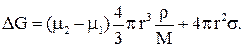
Из анализа данного соотношения следует, что самопроизвольно процесс образования новой фазы возможен при определённом соотношении m2 и m1.
При Т £ Тнд m2 ³ m1, и в этом случае появление зародыша любого размера термодинамически невозможно.
Если же Т > Тнд, то m2 >m1, и слагаемые в формуле для DG имеют разный знак, поскольку с ростом r первое слагаемое растёт по абсолютной величине быстрее, то и кривая DG = f(r) имеет максимум, положение которого определяет величину критического зародыша, рост которого сопровождается уменьшением энергии системы. При некоторых условиях зародыш новой фазы становится термодинамически устойчив. Степень перегрева соединения АВтв определяет как радиус критического зародыша, так и его стабильность. Для определения размера критического зародыша необходимо исследовать функцию DG = f(r) на экстремум, после чего получим
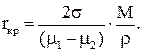
Величина Dm = m1 – m2 называется химическим пресыщением и является движущей силой процесса диссоциации.
На рис. 3.6 показано условие возникновения и роста зародыша новой фазы.
Из анализа зависимостей следует, что при прочих равных условиях, чем больше перегрев, тем меньше критический зародыш и легче (быстрее) идёт процесс диссоциации соединений.
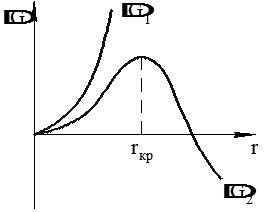
Рис. 3.6. Условия роста зародыша новой фазы
Таким образом, рост зародыша новой среды зависит от температуры, времени и подвижности частиц, образующих новую среду. Изучение механизма конкретного превращения позволяет определить аналитические зависимости, однако они приемлемы, как правило, только для анализируемого случая. При этом необходимо учитывать естественные затруднение роста, связанные с «перекрытием» зародыша новой фазы и лимитирования процесса какой-либо элементарной его стадией.
Реальные системы существенно могут отличаться от создаваемых моделей диссоциации, при создании которых следует обращать внимание на следующие особенности: в начальный момент времени возможны более медленный рост зародышей; поверхностная скорость продвижения границы раздела фаз может отличаться от скорости проникновения в объем; реакционная способность границы изменяется во времени; объем продуктов и реагентов могут не совпадать; при обратимых реакциях возможна адсорбция летучих продуктов реакции; возможно проявление диффузионного торможения; кинетические характеристики, как правило, зависят от размеров частиц; возможны затруднения при передаче тепла через продукты реакции.
Некоторые из перечисленных особенностей процессов диссоциации могут быть лимитирующими звеньями, к которым относятся:
1) скорость химического превращения (так называемый кинетический режим);
2) скорость диффузии газа через покровный слой (диффузионный режим);
3) смешанный режим (сопоставимость скоростей химического превращения и диффузии);
4) скорость переноса тепла реакции через покровный слой.
Каждая из указанных стадий может быть выражена аналитически применительно к процессу диссоциации того или иного соединения с учетом его особенностей.
 2015-05-05
2015-05-05 881
881








