Термодинамика процессов диссоциации оксидов аналогична процессу диссоциации карбонатов, особенности связаны лишь с наличием у некоторых металлов различной степени валентности – в частности, у оксидов железа.
В соответствии с принципом Байкова, диссоциация оксидов железа происходит последовательно, от высшего к низшему вплоть до образования металла. Реакции диссоциации имеют следующий вид:
6Fe2O3 = 4Fe3O4 + O2, DG°Т = 428 300 - 281,3 Т Дж; (3.2)
2Fe3O4 = 6FeO + O2, DG°Т = 624 400 - 250,2 Т Дж; (3.3)
2FeO = Fe + O2, DG°Т = 529 800 - 130,7 Т Дж; (3.4)
1/2Fe3O4 = 3/2Fe + O2, DG°Т = 553 440 - 160,2 Т Дж. (3.5)
Указанные оксиды существуют в определенных температурных интервалах. На рис. 3.3 представлены графики зависимостей DG°Т от температуры реакций (1)–(4).
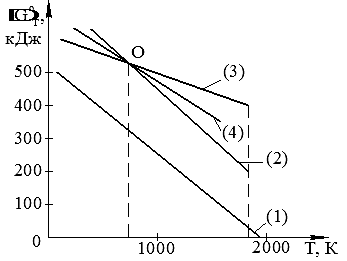
Рис. 3.3. Стандартная энергия Гиббса реакций диссоциации оксидов железа
По рассчитанным величинам упругостей диссоциации построены зависимости 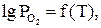 представленные на рис. 3.4.
представленные на рис. 3.4.
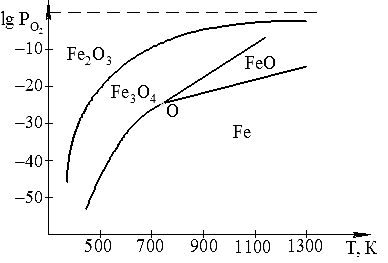
Рис. 3.4. Области устойчивого существования
железа и его оксидов
На данной диаграмме указаны области устойчивого существования чистого железа и его оксидов в широком температурном интервале. Точка O соответствует нонвариантному равновесию с параметрами Т = 575°С и 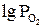 » - 26 (в равновесии находятся четыре фазы – твердые Fe, FeO, Fe3O4 и О2). На остальных линиях реализуется нонвариантное равновесие. Любая точка между линиями отвечает фиксированному состоянию бивариантной системы, что позволяет определить условия устойчивого существования данной конденсированной фазы.
» - 26 (в равновесии находятся четыре фазы – твердые Fe, FeO, Fe3O4 и О2). На остальных линиях реализуется нонвариантное равновесие. Любая точка между линиями отвечает фиксированному состоянию бивариантной системы, что позволяет определить условия устойчивого существования данной конденсированной фазы.
 2015-05-05
2015-05-05 3231
3231








