ГОСУДАРСТВЕННЫЙ КОМИТЕТ РОССИЙСКОЙ ФЕДЕРАЦИИ ПО РЫБОЛОВСТВУ
АСТРАХАНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ

кафедра физики
Кушкин С.А.
Методические рекомендации для выполнения лабораторной работы
по физике:
«Определение отношения теплоёмкостей газа
методом адиабатического расширения».
Для студентов всех специальностей
очной и заочной формы обучения.
астрахань – 2010 г.
Лабораторная работа №1
Определение отношения теплоёмкостей газа
методом адиабатического расширения
Цель работы: Определение коэффициента Пуассона для воздуха
Приборы и принадлежности: Стеклянный баллон, соединённый с манометром, компрессор
Краткая теория
Одним из основных теплофизических свойств тел, используемых в термодинамике, является теплоемкость.
Теплоемкостью тела называется физическая величина, численно равная тепловой энергии (теплоте) d¢Q, подведенной к телу при изменении его температуры на 1К в термодинамическом процессе:
С*х = 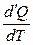 , Дж/К
, Дж/К
Теплоемкость тела зависит от химического состава, массы тела и его термодинамического состояния, а также от вида термодинамического процесса изменения этого состояния. Теплоемкость тела является экстенсивным свойством вещества, т.к. зависит от количества вещества в теле. Поэтому вместо теплоемкости используют понятия удельной теплоемкости.
Различают:
· удельную массовую теплоемкость с х – это теплоемкость единицы массы вещества
сх = dC*x / dm, Дж/(кг×К);
· удельную объемную теплоемкость с х¢ - теплоемкость единицы объема:
сх ¢ = dC*x / dV = cxr, Дж/(м3×К);
· а также молярную теплоемкость С мх – это теплоемкость одного моля вещества:
Сх = Mcx, Дж/(моль×К).
Как было указано выше, удельная теплоемкость зависит не только от строения вещества, но и от вида термодинамического процесса. Наиболее часто на практике используются теплоемкости изобарного (х = P = сonst) и изохорного (х = V = const) процессов. Эти теплоемкости называются изобарной с р и изохорной с v.
Первый закон термодинамики в дифференциальной форме
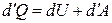 , (1)
, (1)
где d¢Q=mcxdT – элементарное количество теплоты, подводимой к термодинамической системе, затрачивается на увеличение её внутренней энергии dU и на элементарную работу d¢A = рdV, совершаемую системой против внешних сил.
Рассмотрим два термодинамических процесса для m кг вещества:
1) Однородное вещество нагревается при постоянном объёме
(V = const). В этом случае d V = 0 и работа d¢ A = P d V = 0, следовательно, вся теплота d¢Q, подведенная к веществу, идёт на увеличение его внутренней энергии dU:
m d′ q = m cv dT = mdu. (2)
Т.к. величина du является полным дифференциалом, то из (2) следует, что удельная изохорная теплоемкость равна
cv = 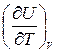
2) Вещество нагревается при постоянном давлении (P = const).
В этом случае теплота, подводимая к веществу, идёт не только на увеличение его внутренней энергии d U, но и на совершение системой работы d¢ A против внешних сил:
d¢Q = dU + d¢A (3)
Следовательно, удельная теплоёмкость при постоянном давлении c p больше удельной теплоёмкости при постоянном объёме c 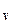 , т.е. c p > c
, т.е. c p > c 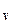 .
.
Первый закон термодинамики для изобарного процесса (d Р = 0) можно представить в следующем виде
mc pd T = m (d u + Р d V) = m [d(u+РV)- V d Р ] = m d i, (4)
где i = u+ РV – удельная энтальпия вещества (параметр его состояния), Дж/кг.
Для изобарного процесса величина V d Р = 0. Отсюда следует, что удельная изобарная теплоемкость вещества равна:
c p = 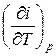
Установим связь между удельными и молярными теплоёмкостями идеального газа для этих процессов. Учитывая, что внутренняя энергия и энтальпия идеального газа зависят только от температуры, а РV = RT / M, из (4) получим
d(i – u) = d(РV) или (с р - c v)d T = R / M d T.
Отсюда следует, что
с р - c v = R / M.
 2015-05-05
2015-05-05 490
490








