Между количеством вещества, выделившегося при электролизе и количеством прошедшего через электролит электричества существует связь, которая определяется двумя законами Фарадея
(1834 г.)
I закон Фарадея. Масса веществ, выделившихся на электродах при электролизе, прямо пропорциональна количеству электричества, прошедшего через раствор электролита.
II закон Фарадея. Одинаковые количества электричества выделяют при электролизе на электродах эквивалентные массы различных веществ.
Закон Фарадея выражается уравнением:
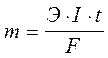 ;
; 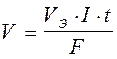 , где
, где
m - масса образовавшегося или подвергшегося превращению вещества, г;
Э - его эквивалентная масса, г/моль;
I - сила тока, А;
t - время, с;
F - постоянная Фарадея, 96500 Кл/моль;
V - объем образовавшегося или подвергшегося превращению вещества, л;
VЭ - его эквивалентный объем, л/моль.
Отношение массы реально выделившегося на электроде вещества к теоретическому называется выходом по току (ВТ).
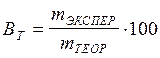 , %
, %
Пример 7. Водный раствор хлорида магния подвергался электролизу 1 час при силе тока 2,5 А. Какие продукты и в каком количестве выделились?
Решение:
Диссоциация хлорида магния:
MgCl2 ® Mg2++ 2Cl—
Схема электролиза:
К: 2Н2О + 2е— ® Н2 + 2ОН— ê1
А: 2 Cl— - 2е— ® Сl2 ê1
——————————————————————
2Н2О +2 Cl— ® Н2 + 2ОН— + Сl2
Mg2++2Н2О +2 Cl— ® Н2 + 2ОН—+ Mg2++ Сl2
или MgCl2 + 2Н2О электролиз ® Н2 + Mg(ОН)2+ Сl2
Исходя из схемы электролиза, в результате процесса в катодном пространстве образуются водород и гидроксид магния, а на аноде - хлор. Определяем эквиваленты продуктов электролиза:
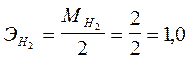 г/моль;
г/моль;
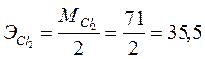 г/моль;
г/моль;
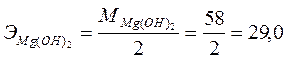 г/моль.
г/моль.
По закону Фарадея вычисляем массы образовавшихся веществ.
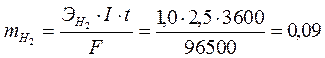 г
г
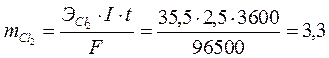 г
г
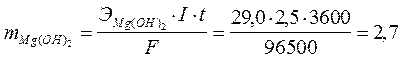 г
г
Пример 8. Ток силой 2,5 А, проходя через раствор электролита, за 30 минут выделяет из раствора 2,77 г металла. Найти эквивалентную массу металла.
Решение:
Исходя из закона Фарадея,
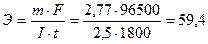 г/моль
г/моль
 2015-05-05
2015-05-05 3971
3971
