В анаэробных условиях пировиноградная кислота (пируват) подвергается дальнейшим превращениям в ходе спиртового, молочнокислого и других видов брожений, при этом NADH используется для восстановления конечных продуктов брожения, регенерируя в окисленную форму. Последнее обстоятельство поддерживает процесс гликолиза, для которого необходим окисленный NAD +. В присутствии достаточного количества кислорода пируват полностью окисляется до С02 и Н20 в дыхательном цикле, получившем название цикла Кребса или цикла ди- и трикарбоновых кислот. Все участки этого процесса локализованы в матриксе или во внутренней мембране митохондрий. Непосредственно в цикле окисляется ле сам пируват, а его производное — ацетил-СоА. Таким образом, первым этапом на пути окислительного расщепления ПВК является процесс образования активного ацетила в ходе окислительного декарбоксилирования. Окислительное декарбоксилирование пирувата осуществляется при участии пируватдегидрогеназного мультифёрментного комплекса. В состав его входят три фермента и пять коферментов. Коферментами служат тиаминпирофосфат (ТПФ) — фосфорилированное производное витамина Вь липоевая кислота, коэнзим A, FAD и NAD+. Пируват взаимодействует с ТПФ (декарбоксилазой), при этом отщепляется С02 и образуется гидроксиэтильное производное ТПФ (рис. 4.2). Последнее вступает в реакцию с окисленной формой липоевой кислоты. Дисульфидная связь липоевой кислоты разрывается и происходит окислительно-восстановительная реакция: гидроксиэтильная группа, присоединенная к одному атому серы, окисляется в ацетильную (при этом возникает высокоэнергетическая тиоэфирная связь), а другой атом серы липоевой кислоты восстанавливается. Образовавшаяся ацетиллипоевая кислота взаимодействует с коэнзимом А, возникают ацетил- СоА и восстановленная форма липоевой кислоты. Водород липоевой кислоты переносится затем на FAD и далее на NAD +. В результате окислительного декарбоксилирования пирувата образуются ацетил-СоА, С02 и NADH.
Дальнейшее окисление ацетил-СоА осуществляется в ходе циклического процесса. Цикл Кребса начинается с взаимодействия ацетил-СоА с енольной формой щавелевоуксусной кислоты. В этой реакции под действием фермента цитратсинтазы образуется лимонная кислота. Следующий этап цикла включает две реакции и катализируется ферментом аконитазой, или аконитатгидратазой. В первой реакции в результате дегидратации лимонной кислоты образуется цис- аконитовая. Во второй реакции аконитат гидратируется и синтезируется изолимонная кислота. Изолимонная кислота под действием NAD- или NADP-зависимой изоцитратдегидрогеназы окисляется в нестойкое соединение — щавелевоянтарную кислоту, которая тут же декарбоксилируется с образованием а-кетоглутаровой кислоты (а-оксоглутаровой кислоты).
а-Кетоглутарат, подобно пирувату, подвергается реакции окислительного декарбоксилирования. а-Кетоглутаратдегидрогеназный мультиэнзимный комплекс сходен с рассмотренным выше пируватдегидрогеназным комплексом. В ходе реакции окислительного декарбоксилирования а-кетоглутарата выделяется С02, образуются NADH и сукцинил-СоА.
Подобно ацетил-СоА, сукцинил-СоА является высокоэнергетическим тиоэфиром. Однако если в случае с ацетил-СоА энергия тиоэфирной связи расходуется на синтез лимонной кислоты, энергия сукцинил-CoA может трансформироватся в образование фосфатной связи АТР. При участии сукцинил- СоА-синтетазы из сукцинил-СоА, ADP и Н3Р04 образуются янтарная кислота (сукцинат), АТР, регенерирует молекула СоА. АТР образуется в результате субстратного фосфорилирования.
На следующем этапе янтарная кислота окисляется до фумаровой. Реакция катализируется сукцинатдегидрогеназой, коферментом которой является FAD. Фумаровая кислота под действием фумаразы или фумаратгидратазы, присоединяя Н20, превращается в яблочную кислоту (малат). И, наконец, на последнем этапе цикла яблочная кислота с помощью NAD- зависимой малатдегидрогеназы окисляется в щавелевоуксусную. ЩУК, которая самопроизвольно переходит в енольную форму, реагирует с очередной молекулой ацетил-СоА и цикл повторяется снова.
Следует отметить, что большинство реакций цикла обратимы, однако ход цикла в целом практически необратим. Причина этого в том, что в цикле есть две сильно экзергонические реакции — цитратсинтазная и сукцинил-СоА-синтетазная.
На протяжении одного оборота цикла при окислении пирувата происходит выделение трех молекул С02, включение трех молекул Н2О и удаление пяти пар атомов водорода. Роль Н2О в цикле Кребса подтверждает правильность уравнения Палладина, который постулировал, что дыхание идет с участием Н2О, кислород которой включается в окисляемый субстрат, а водород с помощью «дыхательных пигментов» (по современным представлениям — коферментов дегидрогеназ) переносится на кислород.
Выше отмечалось, что цикл Кребса был открыт на животных объектах. Существование его у растений впервые доказал английский исследователь А. Чибнелл (1939).В растительных тканях содержатся все кислоты, участвующие в цикле; обнаружены все ферменты, катализирующие превращение этих кислот; показано, что малонат — ингибитор сункцинатдегидрогеназы — тормозит окисление пирувата и резко снижает поглощение 02 в процессах дыхания у растений. Большинство ферментов цикла Кребса
локализовано в матриксе митохондрий, аконитаза и сукцинатдегидрогеназа — во внутренней мембране митохондрии.
Энергетический выход цикла Кребса, его связь с азотным обменом. Цикл Кребса. играет чрезвычайно важную роль в обмене веществ растительного организма. Он служит конечным этапом окисления не только углеводов, но также белков, жиров и других соединений. В ходе реакций цикла освобождается основное количество энергии, содержащейся в окисляемом субстрате, причем большая часть этой энергии не теряется для организма, а утилизируется при образовании высокоэнергетических конечных фосфатных связей АТР.
Каков же энергетический выход цикла Кребса? В ходе окисления пирувата имеют место 5 дегидрирований, при этом получаются 3NADH, NADPH (в случае изоцитратдегидрогеназы) и FADH2. Окисление каждой молекулы NADH (NADPH) при участии компонентов электронтранспортной цепи митохондрий дает по 3 молекулы АТР, а окисление FADH2 — 2АТР. Таким образом при полном окислении пирувата образуются 14 молекул АТР. Кроме того, 1 молекула АТР синтезируется; в цикле Кребса в ходе субстратного фосфорилирования. Следовательно, при окислении одной молекуйы пирувата может образоваться 15 молекул АТР. А поскольку в процессе гликолиза из молекулы глюкозы возникают две молекулы пирувата, их окисление даст 30 молекул АТР.
Итак, при окислении глюкозы в процессе дыхания при функционировании гликолиза и цикла Кребса в общей сложности образуются 38 молекул АТР (8 АТР связаны с глико- лизом). Если принять, что энергия третьей сложноэфирнои фосфатной связи АТР равняется 41,87 кДж/моль (10 ккал/моль), то энергетический выход гликолитического пути аэробного дыхания составляет 1591 кДж/моль (380 ккал/моль).
Регуляция цикла Кребса. Дальнейшее использование образующегося из пирувата ацетил-СоА зависит от энергетического состояния клетки. При малой энергетической потребности клетки дыхательным контролем тормозится работа дыхательной цепи, а следовательно, реакций ЦТК и образования интермедиатов цикла, в том числе оксалоацетата, вовлекающего ацетил-СоА в цикл Кребса. Это приводит к большему использованию ацетил-СоА в синтетических процессах, которые также потребляют энергию.
Особенностью регуляции ЦТК является зависимость всех четырех дегидрогеназ цикла (изоцитратдегидрогеназы, а-кетоглутаратдегидрогеназы, сукцинатдегидрогеназы, малатдегидрогеназы) от отношения [NADH]/[NAD + ]. Активность цитратсинтазы тормозится высокой концентрацией АТР и собственным продуктом — цитратом. Изоцитратдегидрогеназа ингибируется NADH и активируется цитратом. а-Кето- глутаратдегидрогеназа подавляется продуктом реакции — сукцинил-СоА и активируется аденилатами. Окисление сукцината сукцинатдегидрогеназой тормозится оксалоацетатом и ускоряется АТР, ADP и восстановленным убихиноном (QH2). Наконец, малатдегидрогеназа ингибируется оксалоацетатом и у ряда объектов — высоким уровнем АТР. Однако степень участия величины энергетического заряда, или уровня адениновых нуклеотидов, в регуляции активности цикла Кребса у растений до конца не выяснена.
Регулирующую роль может играть также альтернативный путь транспорта электронов в растительных митохондриях. В условиях высокого содержания АТР, когда активность основной дыхательной цепи снижена, окисление субстратов через альтернативную оксидазу (без образования АТР) продолжается, что поддерживает на низком уровне отношение NADH/NAD+ и снижает уровень АТР. Все это позволяет циклу Кребса функционировать.
15Витамины D, А. Структура. Химические свойства
Витамин D — группа биологически активных веществ (в том числе холекальциферол и эргокальциферол). Холекальциферол синтезируется под действием ультрафиолетовых лучей в коже и поступает в организм человека с пищей. Эргокальциферол может поступать только с пищей.
Витамины группы D являются незаменимой частью пищевого рациона человека. Суточная потребность (RDA) в возрасте от 1 до 70 лет (включая беременных и кормящих матерей) составляет 15 мкг холекальциферола или 600 ME (международных единиц)[1].
Сам витамин D (холекальциферол и эргокальциферол) на самом деле является провитамином. Для активации холекальциферол сначала должен превратиться в печени в 25-гидрокси-холекальциферол (сокращенно 25(HO)D), а затем в почках — в 1,25-дигидрокси-холекальциферол (кальцитриол). При оценке адекватности обеспечения конкретного человека витамином D, наиболее полезным и универсальным лабораторным показателем является концентрация 25-гидрокси-холекальциферола в сыворотке крови[2]. Её минимальное значение, обеспечивающее оптимальное здоровье костей у большинства людей в популяции, составляет 20 нг/мл (50 нмоль/л)[1]. Однозначно установить дополнительную пользу от достижения значений выше 30 нг/мл (75 нмоль/л) в клинических исследованиях не удалось[1]. Тем не менее согласно некоторым рекомендациям, «оптимальным» считается интервал 30-60 нг/мл (75-150 нмоль/л)[3].
Растворим в жирах. Жиры также необходимы для адекватного всасывания этого витамина в кишечнике. Основным источником промышленного получения витамина D (эргостерола) служат дрожжи[4].
Дефицит витамина D — явление достаточно распространённое. В США, по данным[5] крупного популяционного исследования, проведенного в 2001—2006 годах, распространенность «риска дефицита» витамина D у взрослых и детей старше 1 года составила 8 %. К ней можно прибавить 24 % людей со статусом «риск неадекватного потребления». В сумме это почти треть населения США. В ряде других стран, с достаточным уровнем солнечного облучения, таких как Индия, Пакистан, Иран, Китай, значительная доля населения (по некоторым данным, до 60-80 %) имеют симптомы дефицита витамина D[6][7].
Однако, приводимые цифры распространенности «дефицита» витамина D могут значимо отличаться в зависимости от того, какой уровень 25-гидрокси-холекальциферола в крови берётся за пограничный (16, 20 или 30 нг/мл или какой-либо другой). Институт медицины США в 2010 году ввел новую классификацию адекватности статуса витамина D в зависимости от уровня 25-гидрокси-холекальциферола в сыворотке крови[1].
| Категория статуса витамина D | Уровень 25(HO)D (нг/мл) | Уровень 25(HO)D (нмоль/л) |
| риск дефицита | < 12 | < 30 |
| риск неадекватного потребления | 12–19 | 30–49 |
| достаточное потребление | 20–50 | 50–125 |
| уровень, выше которого есть основание для обеспокоенности | > 50 | > 125 |
25(HO)D — концентрация 25-гидрокси-холекальциферола в сыворотке крови
Долговременный дефицит витамина D может приводить к увеличению заболеваемости раком[8], увеличивает вероятность развития остеопороза. Гиповитаминоз D играет основную роль в развитии рахита у детей.
Гипервитаминоз витамина D может вызывать нарушения метаболизма кальция, приводящие к гиперкальциемии и гиперкальциурии. При длительном лечении эргокальциферолом или холекальциферолом гиперкальциемия обычно обусловлена накоплением провитамина D3, но может быть вызвана одновременным избыточным потреблением пищевых продуктов, содержащих много кальция, например молочных продуктов[9].
· Синтез в организме: предшественник холекальциферола — превитамин D3 образуется в эпидермисе кожи под воздействием ультрафиолетовых лучей солнечного света из провитамина D3. Превитамин D3 превращается в холекальциферол путем термической изомеризации (при температуре тела). В эпидермисе холекальциферол связывается с витамин-D-связывающим белком и в таком виде поступает в кровь и переносится в печень[9].
· Животные: жирные сорта рыбы, рыбий жир; в значительно меньшей степени сливочное масло, сыр и другие жирные молочные продукты, яичный желток, икра[10]
· Растительные: эргокальциферол образуется в клетках грибов из эргостерола. Основным источником эргокальциферола для человека являются некоторые виды грибов[11].
В расчете на 100 г, в печени животных содержится до 50 ME витамина, в сливочном масле — до 35 ME, в яичном желтке — 25 ME, в мясе — 13 ME, в кукурузном масле — 9 ME, в молоке — от 0,3 до 4 ME на 100 мл при суточной потребности человека 600 ME[12], поэтому даже при диете, ограниченной этими продуктами питания и лишенной жирной морской рыбы, без достаточного нахождения на солнце потребность организма в витамине D не может быть полностью обеспечена[13].
[править]Суточная норма витамина D
| Возраст | Рекомендуемая суточная норма витамина D [14], МЕ | Безопасный верхний предел витамина D, МЕ |
| 0 - 12 месяцев | 1000 - 1500 | |
| 1-13 лет | 2500 - 4000 | |
| 14-18 лет | ||
| 19-70 лет | ||
| 71 год и старше | ||
| Беременные и кормящие женщины |
[править]Функции
Главной функцией витамина D является обеспечение всасывания кальция из продуктов питания в тонком кишечнике (преимущественно в двенадцатиперстной кишке). Также ряд клинических исследований заставляет предполагать следующие дополнительные функции витамина D: участие в регуляции размножения клеток, обменных процессов, стимуляция синтеза ряда гормонов.
[править]Формы
| Название | Химическая структура | Строение |
| Витамин D1 | сочетание эргокальциферола с люмистеролом, 1:1 | |
| Витамин D2 | эргокальциферол (производное эргостерола) | 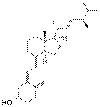 |
| Витамин D3 | холекальциферол (образуется из 7-дигидрохолестерола в коже) | 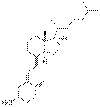 |
| Витамин D4 | 22-дигидроэргокальциферол | 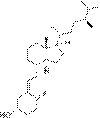 |
| Витамин D5 | ситокальхиферол (производное 7-дигидроситостерола) |  |
Ретино́л (истинный витамин A, транс-9,13-Диметил-7-(1,1,5-триметилциклогексен-5-ил-6)-нонатетраен-7,9,11,13-ол) — жирорастворимыйвитамин, антиоксидант. В чистом виде нестабилен, встречается как в растительных продуктах, так и в животных источниках. Поэтому производится и используется в виде ретинола ацетата и ретинола пальмитата. В организме синтезируется из бета-каротина. Необходим для зрения и роста костей, здоровья кожи и волос, нормальной работы иммунной системы и т.д.
Открыт в 1913 году двумя независимыми группами учёных (Мак-Коллут — Дэвис и Осборн).[1] Первый из открытых витаминов, в связи с чем получил буквенное обозначение «A» в соответствии с алфавитной номенклатурой.
В высоких дозах оказывает тератогенное действие (способен вызывать врожденные дефекты развития плода). Тератогенное действие высоких доз ретинола сохраняется и некоторое время после его отмены.[ источник не указан 972 дня ]
Ретинол является жирорастворимым, поэтому для его усваивания пищевым трактом требуются жиры, а также минеральные вещества. В организме его запасы остаются достаточно долго, чтобы не пополнять его запасы каждый день. Существует две формы этого витамина: это готовый витамин А (ретинол) и провитамин А (каротин), который в организме человека превращается в витамин A, поэтому его можно считать растительной формой витамина A.При недостатке витамина А на коже образуются трещины, секутся волосы и слоятся ногти. Витамин A имеет бледно-желтый цвет, который образуется из красного растительного пигмента бета-каротина.
Близкие по структуре соединения:
· ретинол (витамин А-спирт, аксерофтол, антиксерофтальмический);
· дегидроретинол;
· ретиналь (ретинен, витамин А-альдегид);
· ретиноевая кислота (витамин А-уксусная кислота);
· пространственные изомеры.
[править]Источники
| Растительные (каротин) | Животные | Синтез в организме |
| Зеленые и жёлтые овощи (морковь, тыква, сладкий перец, шпинат, брокколи, зелёный лук, зелень петрушки), бобовые (соя, горох),персики, абрикосы, яблоки, виноград, арбуз, дыня, шиповник, облепиха, черешня; травы (люцерна, листья бурачника, кореньлопуха, кайенский перец, фенхель, хмель, хвощ, ламинария, лимонник, коровяк, крапива, овёс, петрушка, мята перечная,подорожник, листья малины, клевер, плоды шиповника, шалфей, толокнянка, листья фиалки, щавель). | Рыбий жир, печень (особенно говяжья), икра, молоко,сливочное масло, маргарин,сметана, творог, сыр, яичный желток | Образуется в результате окислительного расщепления β-каротина |
Лучшие источники витамина А — рыбий жир и печень, следующими в ряду стоят сливочное масло, яичный желток, сливки и цельное молоко. Зерновые продукты и снятое молоко, даже с добавками витамина, являются неудовлетворительными источниками, равно как и говядина, где витамин А содержится в ничтожных количествах.
[править]Функции
Витамин А участвует в окислительно-восстановительных процессах, регуляции синтеза белков, способствует нормальному обмену веществ, функции клеточных и субклеточных мембран, играет важную роль в формировании костей и зубов, а также жировых отложений; необходим для роста новых клеток, замедляет процесс старения.
Витамин А поддерживает ночное зрение путём образования пигмента, называемого родопсин, способного улавливать минимальный свет, что очень важно для ночного зрения. Он также способствует увлажнению глаз, особенно уголков, предохраняя их от пересыхания и последующего травмирования роговицы.
Витамин А необходим для нормального функционирования иммунной системы и является неотъемлемой частью процесса борьбы с инфекцией. Применение ретинола повышает барьерную функцию слизистых оболочек, увеличивает фагоцитарную активность лейкоцитов и других факторов неспецифического иммунитета. Витамин А защищает от простуд, гриппа и инфекций дыхательных путей, пищеварительного тракта, мочевых путей. Наличие в крови витамина А является одним из главных факторов, ответственных за то, что дети в более развитых странах гораздо легче переносят такие инфекционные заболевания как корь, ветряная оспа, тогда как в странах с низким уровнем жизни намного выше смертность от этих «безобидных» вирусных инфекций. Обеспеченность витамином А продлевает жизнь даже больным СПИДом.
Ретинол необходим для поддержания и восстановления эпителиальных тканей, из которых состоят кожа и слизистые покровы. Не зря практически во всех современных косметических средствах содержатся ретиноиды — его синтетические аналоги. Действительно, витамин А применяется при лечении практически всех заболеваний кожи (акне, прыщи, псориази т. д.). При повреждениях кожи (раны, солнечные ожоги) витамин А ускоряет процессы заживления, а также стимулирует синтез коллагена, улучшает качество вновь образующейся ткани и снижает опасность инфекций.
Ввиду своей тесной связи со слизистыми оболочками и эпителиальными клетками витамин А благотворно влияет на функционирование легких, а также является стоящим дополнением при лечении некоторых болезней желудочно-кишечного тракта (язвы, колиты).
Ретинол необходим для нормального эмбрионального развития, питания зародыша и уменьшения риска таких осложнений беременности, как малый вес новорожденного.
Витамин А принимает участие в синтезе стероидных гормонов (включая прогестерон), сперматогенезе, является антагонистом тироксина — гормона щитовидной железы.
Как витамин А, так и β-каротин, будучи мощными антиоксидантами, являются средствами профилактики и лечения раковых заболеваний, в частности, препятствуя повторному появлению опухоли после операций.
И витамин А, и β-каротин защищают мембраны клеток мозга от разрушительного действия свободных радикалов, при этом β-каротин нейтрализует самые опасные виды свободных радикалов: радикалы полиненасыщенных кислот и радикалы кислорода.
Антиоксидантное действие β-каротина играет важную роль в предотвращении заболеваний сердца и артерий, он обладает защитным действием у больных стенокардией, а также повышает содержание в крови «полезного» холестерина (ЛПВП).
Лютеин и зеаксентин — главные каротиноиды, защищающие наши глаза: они способствуют предупреждению катаракты, а также снижают риск дегенерации желтого пятна (важнейшего органа зрения), которая в каждом третьем случае является причиной слепоты. При авитаминозе витамина А развивается кератомаляция.
Ещё один каротиноид — ликопин (содержится в основном в помидорах) защищает от атеросклероза, предотвращая окисление и накопление на стенках артерий холестерина низкой плотности. Кроме того, это самый «сильный» каротиноид в отношении защиты от рака, особенно рака молочной железы, эндометрия и простаты.
Укрепляет кости.
[править]Суточная потребность
Рекомендуемой суточной дозой витамина А является:
· 900 мкг (3000 ME) для взрослых (для беременных больше на 100 мкг, для кормящих — на 400 мкг);
· 400—1000 мкг для детей, в зависимости от возраста и пола;
· При заболеваниях, связанных с недостаточностью ретинола, дозировка может быть увеличена до верхнего допустимого уровня потребления — 3000 мкг.
Вышеприведенные дозировки относятся исключительно к ретиноидной форме витамина А. Каротиноидная форма не столь токсична.[2]
[править]Неравнозначность ретиноидов и каротиноидов
Поскольку часть каротиноидов могут преобразовываться в организме в витамин A, для сравнения ценности продуктов питания необходимо понимать, сколько употреблённых с пищей каротиноидов равноценны определённому количеству ретинола. Некоторая путаница возникает из-за того, что представление об эквивалентном количестве с течением времени менялось.
В течение многих лет использовалась система, основанная на международных единицах (МЕ). Одна МЕ равнялась 0,3 мкг ретинола, 0,6 мкг β-каротина или 1,2 мкг других каротиноидов, являющихся провитаминами A.[3]
Позднее стали использовать другую единицу — эквивалент ретинола (ЭР). 1 ЭР соответствовал 1 мкг ретинола, 2 мкг растворённого в жире β-каротина (из-за плохой растворимости в большинстве витаминных комплексов β-каротин растворён лишь частично), 6 мкг β-каротина в обычной пище (т.к. усвояемость в этом случае ниже, чем в случае растворённого в жире β-каротина) или 12 мкг α-каротина, γ-каротина или β-криптоксантина в пище (т.к. из молекул этих каротиноидов образуется на 50 % меньше ретинола по сравнению с молекулами β-каротина).
Более поздние исследования показали, что в действительности усваиваемость каротиноидов в два раза ниже по сравнению с тем, что считалось ранее. В связи с этим в 2001Институт медицины США вводит очередную новую единицу — эквивалент активности ретинола (RAE). 1 RAE соответствует 1 мкг ретинола, 2 мкг растворённого в жире β-каротина, 12 мкг «пищевого» β-каротина или 24 мкг любого из трёх оставшихся каротиноидов, являющихся провитаминами A.[4]
| Вещество и химическое окружение | Микрограмм эквивалента активности ретинола на 1 микрограмм вещества |
| ретинол | |
| бета-каротин, растворённый в жире | 1/2 |
| бета-каротин в пище | 1/12 |
| альфа-каротин в пище | 1/24 |
| гамма-каротин в пище | 1/24 |
| бета-криптоксантин в пище | 1/24 |
Так как синтез ретинола в человеческом организме регулируется объёмом доступного ретинола, преобразование в указанном количестве будет происходить только при недостатке витамина A. На усваиваемость провитаминов также сильно влияет количество липидов, употреблённых одновременно с провитаминами; липиды улучшают усваиваемость провитамина.[5]
Вывод, который можно сделать из последних исследований, заключается в том, что фрукты и овощи далеко не так полезны с точки зрения витамина A, как считалось ранее; другими словами, ценность международных единиц (МЕ) содержащегося в них витамина A существенно ниже по сравнению с растворёнными в жире МЕ и (в некоторой степени) витаминными добавками. Это следует иметь в виду вегетарианцам.
16Место и роль белков в живом организме. Структура белков, химические свойства. Участие белков в мышечной работе.
21Металлы в составе живых организмов.
Живые организмы состоят из огромного числа химических веществ, органических и неорганических, полимерных и низкомолекулярных.
Среди неорганических веществ и компонентов основное место занимает – вода.
Для поддержания ионной силы и рН-среды, при которых протекают процессы жизнедеятельности, необходимы определённые концентрации неорганических ионов.
Основные элементы в живых организмах:
- водород;
-кислород;
-сера;
-азот;
-фосфор;
-углерод.
Неорганические соединения:
-соли аммония;
-карбонаты;
-сульфаты;
-фосфаты.
Неметаллы:
1. Хлор (основной). В виде анионов участвует в создании солевой среды, иногда входит в состав некоторых органических веществ.
2. Йод и его соединения принимают участие в некоторых процессах жизнедеятельности органических соединений (живых организмов). Йод входит в состав гормонов щитовидной железы (тироксина).
тироксин
3. Производные селена. Селеноцестеин, входит в состав некоторых ферментов.
4. Кремний - входит в состав хрящей и связок, в виде эфиров ортокремневой кислоты, принимает участие в шивке полисахаридных цепей.
Большое число органических веществ входит в состав живых организмов:
-уксусная кислота;
-уксусный альдегид;
-этанол (является продуктами и субстратами биохимических превращений).
Много соединений в живых организмах представляют собой комплексы:
-ГЕМ - это комплекс железа с плоской молекулой парафина;
-коболамин.
Для поддержания определённой ионной силы и соединения буферной среды необходимо участие однозарядных ионов:
-аммония(NH4+);
-натрия(Na+);
-калия (К+).
Катионы не являются взаимозамещёнными, существуют специальные механизмы, поддерживающие необходимый баланс между ними.
Магний и кальций – основные металлы не считая, железа – повсеместно распространены в биосистемах. Концентрация ионов магния имеет важное значение для поддержания целостности и функционирования рибосом, то есть для синтеза белков.
Магний также входит в состав хлорофилла. Ионы кальция принимают участие в клеточных процессах в том числе мышечных сокращений. Нерастворённые соли – участвуют в формировании опорных структур:
-фосфат кальция (в костях);
-карбонат (в раковинах моллюсков).
Ионы металлов 4 периода входят в состав ряда жизненно важных соединений – ферментов. Некоторые белки содержат железо в виде железосерных кластеров. Ионы цинка содержатся в значительном числе ферментов. Марганец входит в состав небольшого числа ферментов, но играет важную роль в биосфере, при фотохимическом восстановлении воды, обеспечивает выделение в атмосферу кислорода и поступление электронов в цепь переноса при фотосинтезе.
Кобальт – входит в состав ферментов в виде – кобаламинов (витамин В 12).
Молибден – необходимый компонент фермента – нитродиназа (который катализует восстановление атмосферного азота до аммиака, в азотфиксирующих бактериях)
Основные группы низкомолекулярных соединений живых организмов:
Аминокислоты – являются составными частями белков
Нуклеамиды – составляющая часть нуклеиновых кислот
Моно и алигосахариды – составляющие структурных тканей
Липиды – составные части клеточных стенок.
Кроме предыдущих существуют:
- кофакторы ферментов - необходимые компоненты значительного числа ферментов, катализируют о/в реакции.
Коферменты – органические соединения, функционирующие в определённых системах ферментных реакций. Например: никотиноамидоданин динуклеатид (NAD+)
В окисленной форме – это окислитель спиртовых групп до карбонильных, при этом образуется восстановитель.
Кофакторы ферментом – сложные органические молекулы, синтезируются из сложных предшественников, которые должны присутствовать в качестве обязательных компонентов пищи.
Для высших животных характерно образование и функционирование веществ управляющих нервной и эндокринной системой – гормоны и нейромедитаторы.
Гормон подпочечника – запускающий окислительную переработку гликогена в процессах стрессовой ситуации.
Во многих растениях синтезируется сложный амин обладающий сильным биологическим действием – алкалоиды.
Терпены – соединения растительного происхождения, компоненты эфирных масел и смол.
Камфара
Антибиотики – вещества микробиологического происхождения, выделяемые специальными видами микроорганизмов, подавляющих рост других конкурирующих микроорганизмов. Механизм их действия разнообразен, например замедление роста белков в бактериях.
22Ферменты – биологические катализаторы. Свойства ферментов. Классификация. Ферменты углеводного и белкового обмена
Ферме́нты, или энзи́мы (от лат. fermentum, греч. ζύμη, ἔνζυμον — закваска) — обычно белковые молекулы или молекулы РНК (рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам (АТФаза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу).
Ферментативная активность может регулироваться активаторами и ингибиторами (активаторы — повышают, ингибиторы — понижают).
Белковые ферменты синтезируются на рибосомах, а РНК — в ядре.
Термины «фермент» и «энзим» давно используют как синонимы (первый в основном в русской и немецкой научной литературе, второй — в англо- и франкоязычной).
Наука о ферментах называется энзимологией, а не ферментологией (чтобы не смешивать корни слов латинского и греческого языков).
Ферменты присутствуют во всех живых клетках и способствуют превращению одних веществ (субстратов) в другие (продукты). Ферменты выступают в роли катализаторов практически во всех биохимических реакциях, протекающих в живых организмах — ими катализируется более 4000 разных биохимических реакций[2]. Ферменты играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ организма.
Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Отличительной особенностью ферментов по сравнению с небелковыми катализаторами является их высокая специфичность — константа связываниянекоторых субстратов с белком может достигать 10−10 моль/л и менее. Каждая молекула фермента способна выполнять от нескольких тысяч до нескольких миллионов «операций» в секунду.
Например, одна молекула фермента ренина, содержащегося в слизистой оболочке желудка телёнка, створаживает около 106 молекул казеиногена молока за 10 мин при температуре 37 °C.
При этом эффективность ферментов значительно выше эффективности небелковых катализаторов — ферменты ускоряют реакцию в миллионы и миллиарды раз, небелковые катализаторы — в сотни и тысячи раз. См. также Каталитически совершенный фермент
[править]Классификация ферментов
Основная статья: Шифр КФ
По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов (КФ, EC — Enzyme Comission code). Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
· КФ 1: Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа.
· КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
· КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза.
· КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов.
· КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата.
· КФ 6: Лигазы, катализирующие образование химических связей между субстратами за счёт гидролиза АТФ. Пример: ДНК-полимераза.
Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
23Биохимические процессы при мышечной работе. Ресинтез АТФ. Обмен белков.
Ресинтез АТФ, непрерывно расщепляющейся в процессе деятельности мышцы, осуществляется двумя основными путями. Первый состоит в ферментативном переносе фосфатной группы от богатого энергией фосфорного соединения креатинфосфата на аденозиндифосфорную кислоту. Креатинфосфат содержится в мышце в значительно больших количествах, чем АТФ, и обеспечивает ее ресинтез в течение тысячных долей секунды. Однако при интенсивной работе мышцы запасы креатинфосфата быстро истощаются, поэтому важен второй путь—более медленный ресинтез АТФ. Он связан с гликолитическими и окислительными процессами, протекающими в мышце как в условиях покоя, так и особенно интенсивно во время деятельности. Окисление молочной и пиро-виноградной кислот, образующихся в мышце во время ее сокращения, сопровождается фосфорилированием аденозиндифосфорной кислоты и креатина, т. е. ресинтезом креатинфосфата и АТФ.
Нарушение ресинтеза АТФ ядами, подавляющими гликолитические и окислительные процессы, ведет к полному исчезновению АТФ и креатинфосфата, вследствие чего кальциевый насос перестает работать. Концентрация Са + в области миофибрилл значительно возрастает и мышца приходит в состояние длительного необратимого укорочения.
Теплообразование при сократительном процессе и энергия сокращения
Образование тепла в мышечной ткани при работе было открыто Гельмгольцем и В. Я. Данилевским во второй половине XIX в. В дальнейшем Хиллу с сотр. удалось создать высокочувствительные приборы, которые позволили зарегистрировать и измерить теплопродукцию мышц и нервов в покое и при возбуждении.
24Витамин С. Химические свойства. Значение.
Аскорби́новая кислота́ — органическое соединение, родственное глюкозе, является одним из основных веществ в человеческом рационе, которое необходимо для нормального функционирования соединительной и костной ткани. Выполняет биологические функции восстановителя и кофермента некоторых метаболических процессов, является антиоксидантом. Биологически активен только один из изомеров — L- аскорбиновая кислота, который называют витамином C. В природе аскорбиновая кислота содержится во многихфруктах и овощах.[3] По физическим свойствам аскорбиновая кислота представляет собой белый кристаллический порошок кислого вкуса. Легко растворим в воде, растворим в спирте.[2]
Из-за наличия двух асимметрических атомов существуют четыре диастереомерааскорбиновой кислоты. Две условно именуемые L- и D- формы хиральны относительно атома углерода в фурановом кольце, а изо- форма является D- изомером по атому углерода в боковой этиловой цепи.
L- изоаскорбиновая, или эриторбовая, кислота используется в качестве пищевой добавкиE315.
 2015-05-06
2015-05-06 8239
8239
