Относится к типу слабых взаимодействий. Возникает в случае, когда водород ковалентно связан с сильно электроотрицательным элементом (O, F, N).
Электронная плотность при этом значительно смещена к электроотрицательному атому и на водороде возникает частичный положительный заряд. При приближении к нему электроотрицательного атома другой молекулы между ними возникает сила притяжения.
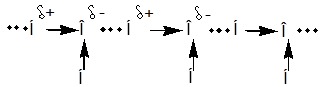
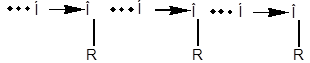
Водородная связь значительно слабее ковалентной. Тем не менее, она оказывает существенное влияние на физико-химические характеристики соединений: температуры кипения и плавления, растворимость в воде. Температура кипения спиртов повышается, т.к. требуется дополнительная энергия для разрушения водородных связей при переводе в парообразное состояние. Иногда образуются прочные ассоциаты, которые не разрушаются и при нагревании, существуя и в парах, например, димеры низших кислот.
 O … H – O
O … H – O
R – C C - R
O – H … O
Из всех известных видов слабых взаимодействий лишь водородные связи обладают требуемой прочностью, необходимой для поддержания высокоорганизованных молекулярных структур и вместе с тем допускают быстрые структурные перегруппировки при температурах, присущих живым организмам.
Т.к. в органических соединениях преобладает ковалентная связь, рассмотрим её более подробно:
Характеристики ковалентной связи:
1. Длина связи
- это равновесное расстояние между ядрами связанных атомов, выражаемое в нанометрах. Половина длины связи в симметричной молекуле (Н2, Сl2…) называется ковалентным радиусом.
1 нм = 10-9 м (нанометр)
2. Энергия связи Е [кДж/моль; ккал/моль]
- это энергия, выделяющаяся при образовании молекулы из одиночных атомов. Обычно чем длиннее связь, тем меньше её энергия.
3. Полярность (статическая поляризация)
- отражает взаимное влияние непосредственно связанных атомов. Ковалентная связь полярна в случаях, когда один из связанных атомов обладает большей ЭО Неполярная ковалентная связь образуется, когда в молекуле связаны два одинаковых атома и электронная плотность распределена равномерно между атомами.
d+ d-
 Н3С Сl
полярная связь Н3С Сl
полярная связь
| Н3С – СН3 неполярная связь |
4. Поляризуемость (динамическая поляризация)
- это способность электронной оболочки атома или молекулы деформироваться под воздействием внешнего поля, вызванного ионами или полярными молекулами. При снятии действия внешнего поля поляризуемость исчезает.
Поляризуемость связи возрастает с уменьшением разности ЭО атомов, образующих связь. Таким образом, существует обратная зависимость между полярностью и поляризуемостью ковалентной связи: чем больше электроны сдвинуты в статической молекуле, тем меньше остается возможности для их смещения под внешним воздействием.
Подобная взаимосвязь хорошо прослеживается на примере молекул галогеноводородов:
НF HCl HBr HJ
 | |||
 |
полярности
поляризуемости
5. Направленность
Объясняется принципом максимального перекрывания атомных орбиталей. Нарушение этого принципа приводит к разрыву связи. Ковалентная связь тем прочнее, чем больше перекрывание электронных орбиталей при данном межъядерном расстоянии. Поэтому молекула, в которой ковалентной связью соединены более двух атомов, имеет определенное пространственное строение.
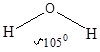
| 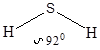
| 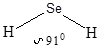
|
При образовании ковалентной связи различают два типа перекрывания атомных орбиталей. Если атомные орбитали перекрываются вдоль оси, соединяющей ядра атомов – это s-перекрывание (s-связь). Ковалентные p-связи образуются путем перекрывания р или d-орбиталей боковыми поверхностями. Чаще всего встречается p-связь, образованная боковым перекрыванием р-орбиталей с параллельными осями.
По прочности p-связь слабее s-связи.
6. Насыщаемость
Это свойство связано с тем обстоятельством, что в атоме в образовании связей участвуют неспаренные электроны и неподеленные пары электронов. Например, атом азота имеет три неспаренных электрона, а атом водорода – один. По принципу насыщаемости устойчивым соединением может быть только NH3.
 2015-05-06
2015-05-06 706
706








