Как уже отмечалось выше, одним из важнейших параметров, характеризующих молекулу, является минимальная потенциальная энергия взаимодействия EP0. Силы притяжения, действующие между молекулами стремятся сконденсировать вещество, т.е. сблизить его молекулы до расстояния r0 (рис.3), когда их потенциальная энергия взаимодействия минимальна и равна EP0, но этому сближению препятствует хаотическое тепловое движение молекул. Интенсивность этого движения определяется средней кинетической энергией молекулы, которая имеет порядок kT, где k - постоянная Больцмана. Агрегатные состояния вещества существенным образом зависят от соотношения величин EP0 и kT.
Предположим, что температура рассматриваемой системы молекул столь высока, что kT >> EP0. В этом случае интенсивное хаотическое тепловое движение мешает силам притяжения соединить молекулы в агрегаты из нескольких частиц, сблизившихся до расстояния r0: при соударениях большая кинетическая энергия молекул будет легко разбивать эти агрегаты на составляющие молекулы и, таким образом, вероятность образования устойчивых агрегатов будет как угодно малой. В этих обстоятельствах рассматриваемые молекулы, очевидно, будут находиться в газообразном состоянии.
Если температура системы частиц очень низкая, т.е. kT << EP0, молекулам, действующими силами притяжения, тепловое движение не может помешать приблизиться друг к другу на расстояние близкое к r0 в определенном порядке. При этом система частиц будет находиться в твердом состоянии, а небольшая кинетическая энергия теплового движения вынудить молекулы совершать беспорядочные малые колебания около определенных положений равновесия (узлов кристаллической решетки).
Наконец, при температуре системы частиц, определяемой из приближенного равенства kT ≈ EP0, кинетическая энергия теплового движения молекул, величина которой примерно равна потенциальной энергии притяжения, не сможет переместить молекулу на расстояние, существенно превышающее r0. В этих условиях вещество будет находиться в жидком агрегатном состоянии.
Таким образом, вещество, в зависимости от своей температуры и величины EP0, присущей данному сорту составляющих его молекул, будет находиться в газообразном, твердом или жидком состоянии. При этом температура перехода из одного агрегатного состояния в другое определяется характерным для данного вещества (сорта молекул) числом EP0.
Известно, что у инертных газов (гелий, неон, аргон и др.) величина EP0 сравнительно мала. Поэтому в широком температурном интервале они пребывают в газообразном состоянии и переходят в жидкость при весьма низких температурах, близких к абсолютному нулю. У металлов EP0, напротив, как правило, велико. Поэтому до достаточно высоких температур металлы находятся в твердом состоянии.
Подытоживая, можно сказать, если вещество находится при
очень низкой температуре, то молекулы имеют очень малую кинетическую энергию и силы притяжения удерживают молекулы вместе в упорядоченной плотно упакованной структуре, или решетке. При этом молекулы совершают колебания возле узлов (положений равновесия) кристаллической решетки с амплитудой тем меньшей, чем ниже температура. Если к кристаллу подвести энергию, его температура повышается, и молекулы все сильнее колеблются относительно своих равновесных положений. Если к кристаллу подведена достаточная энергия, то упорядоченная структура молекулярного кристалла разрушается кинетической энергией теплового движения и молекулы получают возможность свободно "скользить" одна вдоль другой, хотя по-прежнему соприкасаются друг с другом. Эта ситуация соответствует жидкому состоянию, а температура перехода между кристаллическим и жидким состоянием определяется по порядку величины определяется из равенства kTпл = EP0 , где Tпл - температура плавления вещества. Жидкость по-прежнему удерживается силами притяжения, хотя молекулы имеют достаточно большую кинетическую энергию движения, чтобы оставаться в фиксированных положениях равновесия. Если к жидкости подвести еще дополнительную энергию, молекулы начинают двигаться достаточно быстро и способны преодолевать силы притяжения, полностью отделяясь друг от друга и двигаясь в пространстве по независимым траекториям. Эта ситуация соответствует газообразному состоянию, а температура перехода между жидкостью и газом называется температурой кипения.
В заключение этого параграфа отметим, какие виды движений испытывает молекула вещества, находящегося в определенном агрегатном состоянии.
При нормальных условиях расстояние между молекулами в газе в десятки раз (см.пример параграфа 1.1) превышают их размеры; большую часть времени они движутся прямолинейно без взаимодействия и только значительно меньшую часть времени, когда находятся на близких расстояниях от других молекул, взаимодействуют с ними, меняя направление своего движения. Таким образом, в газообразном состоянии движение молекулы выглядит так, как схематично показано на рис.6,а.
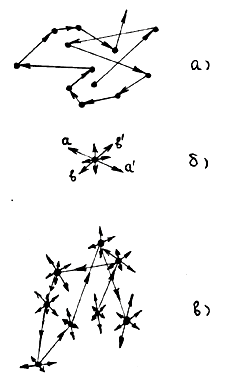
Рис.6
В твердом состоянии каждая молекула (атом) вещества находится в равновесном положении (узел кристаллической решетки), возле которого она совершает малые колебания, причем направление (к примеру, аа′ на рис.6,б) и амплитуда этих колебаний случайно изменяются (к примеру, на направление bb′ ) через время, значительно большее периода этих колебаний; частоты колебаний молекул, расположенных в разных местах, в общем случае, неодинаковы. Траектория движения отдельной молекулы твердого тела в общих чертах представлена на рис.6,б.
Молекулы твердого тела упакованы так плотно, что расстояние между ними примерно равно их диаметру, т.е. расстоянию r0 на рис.3. Из опыта известно, что плотность жидкого состояния примерно на 10 % меньше плотности твердого, при прочих равных условиях. Поэтому расстояние между молекулами жидкого состояния несколько больше r0. Учитывая, что в жидком состоянии молекулы обладают еще и большей кинетической энергией теплового движения, следует ожидать, что, в отличие от твердого состояния, они могут, совершая колебательное движение, достаточно легко менять свое местоположение, перемещаясь на расстояние, существенно не превышающее диаметр молекулы. Траектория движения молекулы жидкости в главных чертах выглядит так, как схематически показано на рис.6,в. Таким образом, движение молекулы в жидкости сочетает в себе поступательное движение, как это имеет место в газе, с колебательным, что наблюдается в твердом теле.
Несмотря на неодинаковый характер движения молекул в различных агрегатных состояниях, общим является случайность, непредсказуемость этих движений. Средняя кинетическая энергия этих беспорядочных движений определяет тепловое состояние вещества, его температуру.
 2015-04-20
2015-04-20 4096
4096
