Рассмотрим систему молекул, занимающую объем V. Состояние этой системы с термодинамической точки зрения описывается набором макроскопических параметров, значение которых устанавливается макроскопическими измерениями. Различают внутренние и внешние параметры. Примером внутренних параметров являются давление P, температура T, внутренняя энергия, поляризованность, намагниченность и т.д. Внутренние параметры описывают внутреннее состояние молекул. Рассматриваемая система молекул может взаимодействовать с окружающей средой, т.е. с внешними по отношению к ней телами, и обмениваться с ней различными видами энергии. Этими внешними телами могут быть, например, заряженные тела, тела, по которым текут токи, тяготеющие массы, источники тепла и т.п., величина воздействия которых на рассматриваемую систему молекул определяется значениями давления, температуры, напряженностей электрического 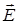 , магнитного
, магнитного 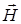 , гравитационного
, гравитационного 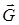 полей и т.д. Величины
полей и т.д. Величины 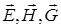 и т.п. называют внешними параметрами.
и т.п. называют внешними параметрами.
Одним из важнейших постулатов молекулярной физики является утверждение о существовании равновесия - состояния, в которое, как показывает опыт, самопроизвольно переходит всякая система молекул, если только внешние условия постоянны. Состояние системы молекул называют равновесным, если при неизменных внешних условиях внутренние параметры, характеризующие ее состояние, не зависят от времени. В состоянии равновесия в системе прекращаются все макроскопические процессы, связанные с переносом тепла (теплопроводность) и вещества (диффузия), останавливаются химические реакции, не имеют места фазовые переходы из одного агрегатного состояния в другое и т.п., т е. не происходят самопроизвольные тепловые процессы и все части системы частиц не совершают никакого макроскопического движения. Однако молекулы, составляющие равновесную систему не прекращают своих хаотических микроскопических движений.
Таким образом, макроскопические процессы в термодинамической системе, находящейся в равновесии, не протекают. Однако, если величину хотя бы одного из внутренних параметров изменить внешним воздействием в одной из частей системы, находившейся до этого в равновесии, затем изолировать ее от внешней среды и представить самой себе, как то, как показывает опыт, в течение определенного промежутка времени, называемого временем релаксации, она перейдет в равновесное состояние. Причем каждый внутренний параметр имеет свое время релаксации, а наибольшее из этих времен, определяет время релаксации системы. Поясним это на примере.
Пусть газ находится в равновесии под поршнем в цилиндрическом сосуде объема V. Газ в этих условиях, очевидно, будет находиться в равновесии, если внешнее давление на поршень равно внутреннему давлению газа (механическое равновесие), температуры газа и внешней среды одинаковы (тепловое равновесие), а внешние поля отсутствуют, (или постоянны во времени). При отсутствии внешних полей давление и температура будут одинаковыми в любой точке объема V, занимаемого газом, характеризуя его в целом. Этому равновесному состоянию соответствует вполне определенная точка на P,V - диаграмме (или на V,T или на P,T - диаграммах) Будем сжимать газ, вдвигая поршень с конечной скоростью υ, Сначала плотность и давление газа увеличатся вблизи поршня. Кроме того, молекулы слоя газа, прилегающие к поршню, приобретут дополнительную кинетическую энергию от движущегося поршня, что приведет к увеличению температуры этого слоя. Сжатый у поршня газ станет распространяться со скоростью звука υЗ; с такой же, по порядку величины, скоростью будет выравниваться давление в цилиндре. Температура же в сжатой части "станет выравниваться" со скоростью "тепловой волны" υТ, которая, как известно из опыта, значительно меньше скорости звука. Поэтому, чтобы процесс выравнивания и температуры и давления успевал произойти по всему объему, занятому газом до следующего сжатия, очевидно, необходимо, чтобы скорость движения поршня была значительно меньше и скорости звука и скорости "тепловой волны", т.е. υ << υT. Последнее условие можно записать в эквивалентном виде: 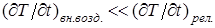 , где
, где 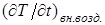 - скорость изменения температуры слоя газа, прилегающего к поршню,
- скорость изменения температуры слоя газа, прилегающего к поршню,
за счет движения поршня, а 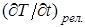 - скорость изменения той же величины при релаксации. Если же скорость поршня бесконечно мала, то тем более внутренние параметры газа будут от одного бесконечно малого внешнего воздействия до другого успевать принимать значения одинаковые по всему объему и, таким образом, газ в любой момент времени будет находиться в равновесии.
- скорость изменения той же величины при релаксации. Если же скорость поршня бесконечно мала, то тем более внутренние параметры газа будут от одного бесконечно малого внешнего воздействия до другого успевать принимать значения одинаковые по всему объему и, таким образом, газ в любой момент времени будет находиться в равновесии.
* Если газ находится в постоянном (независящем от времени) внешнем силовом поле (например, в поле тяжести), то давление будет постоянно в каждой точке объема V, но закономерно изменяется от точки к точке (см.§ 1.11). В этом случае равновесному состоянию газа соответствует вполне определенная точка только на V,T - диаграмме.
Эти рассуждения позволяют ввести определение равновесного процесса. Равновесным называют процесс, представляющий собой непрерывную последовательность равновесных состояний системы молекул. Таким образом, равновесный процесс должен быть бесконечно медленным. Неравновесным называют процесс, при протекании которого система молекул не находится в состоянии равновесия, т.е. при протекании процесса различные части системы имеют различные значения температуры, давления, плотности, концентрации и т.п. Неравновесный процесс проходит последовательность неравновесных состояний, каждое из которых нельзя описать постоянными по всему объему давлением, температурой и т.п. Поэтому неравновесные процессы, в отличие от равновесных, нельзя изобразить графически ни на одной из диаграмм: P-V, T-V или P-T
Состояние термодинамического равновесия, как показывает опыт, описывается небольшим числом макроскопических параметров, причем они не являются независимыми, а связаны некоторым уравнением, которое называют уравнением состояния. К примеру, поведение газов, жидкостей и твердых тел в равновесном состоянии при отсутствии внешних силовых полей описывается только тремя параметрами: давлением P, температурой T и объемом V, которые закономерно связаны уравнением состояния f(P,T,V)=0. При этом вид этого уравнения
зависит не только от агрегатного состояния, но и от химического
состава, рассматриваемой системы молекул. Исключением является
уравнение состояния идеального газа, которое независимо от химического состава имеет один и тот же вид: PV=νRT. Оставаясь в рамках термодинамики невозможно теоретически получить конкретный вид уравнения состояния. Термодинамика заимствует его или из опыта, или из статистической теории, где это уравнение принципиально может быть найдено, но представляет весьма сложную математическую задачу, решенную лишь для небольшого числа простейших систем молекул.
 2015-04-20
2015-04-20 3194
3194
