Наиболее простой теоретической моделью газа является идеальный газ. В этой модели пренебрегают размерами и взаимодействиями молекул и учитывают лишь их упругие столкновения. Более реальной является расширенная модель идеального газа, в которой молекулы представляются упругими сферами с конечным диаметром d, а взаимодействие по-прежнему учитывается только при непосредственном упругом столкновении молекул.
Установим критерий, следуя которому можно установить, когда газ можно рассматривать как идеальный. Ясно, что газ будет идеальным, если расстояние r между его молекулами такое, что силой взаимодействия между ними на этом расстоянии можно пренебречь. Как отмечалось в пункте 3 Введения, силы взаимодействия между молекулами быстро убывают с расстоянием r и уже на расстояниях в несколько диаметров d молекулы пренебрежимо малы. Поэтому условие идеальности газа в расширенном понимании можно записать в виде:
r>>d (1.1.13)
Расстояние r нетрудно выразить через такой важный параметр газа как концентрацию n=N/V, здесь N – число частиц в газе, а V – его объем. В самом деле, если газ находится в равновесии при отсутствии внешних полей его молекулы будут равномерно распределены в объеме V м3, и тогда на ребре куба длиной 1 м расположится 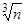 молекул. Следовательно, среднее расстояние между молекулами составит
молекул. Следовательно, среднее расстояние между молекулами составит
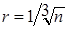 (1.1.14)
(1.1.14)
Из соотношений (1.1.13) и (1.1.14) следует, что критерий идеальности газа можно представить следующим образом
nd 3<< 1, nd 3 – безразмерный параметр (1.1.15)
Учитывая, что из формул (В.9) и (В.10) число частиц в газе N=mNA /m, концентрацию можно выразить через плотность r газа:
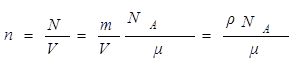 (1.1.16)
(1.1.16)
где r = m/V - плотность газа
Выражение (1.1.16) позволяет записать критерий идеальности газа (1.1.15) в эквивалентной форме
rNAd3/m<<1 (1.1.17)
Пример
1. Является ли азот N2 при нормальных условиях идеальным газом? Каково расстояние между молекулами?
Решение: При нормальных условиях плотность азота ρ =1,251 кг/м3 Поэтому по формуле (1.16) концентрация азота
n = ρNA / m = 1,251·6,02·1023 /28·10-3=2,7·1025 1/м3
Диаметр молекулы азота возьмем из таблицы 1:d = 3,16·10 -10 м. Тогда n d3 = 2,7·1025 · 52,7·10-30 = 0,8·10-3, что является величиной значительно меньшей единицы. Таким образом, условие (1.1.15) выполнено и азот при нормальных условиях является идеальным газом.
При этом расстояние между молекулами 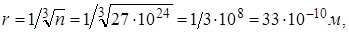 что более чем в десять раз больше диаметра молекулы азота (см.табл.1), а силы притяжения на таких расстояниях пренебрежимо малы
что более чем в десять раз больше диаметра молекулы азота (см.табл.1), а силы притяжения на таких расстояниях пренебрежимо малы
 2015-04-20
2015-04-20 3521
3521








