Химические процессы, сопровождающиеся возникновением электрического тока или вызываемые им, называются электрохимическими.
Металлы имеют кристаллическое строение. При погружении металла в раствор электролита полярные молекулы воды переносят из кристаллической решетки металла некоторое число катионов в раствор. При этом поверхность металла заряжается отрицательно, поскольку на ней появляется избыток электронов, а вода – положительно. На границе поверхности металл-раствор возникает разность потенциалов, называемая электродным потенциалом. Металл, погруженный в раствор электролита, называется электродом.
Электродный потенциал зависит от природы металла, концентрации его ионов в растворе и температуры. Эта зависимость выражается уравнением Нернста:
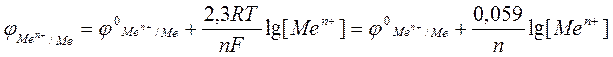 ,
,
где 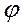
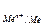 – электродный потенциал металла Ме в растворе, содержащем катионы Меn+, В;
– электродный потенциал металла Ме в растворе, содержащем катионы Меn+, В;
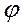 0
0 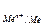 – стандартный электродный потенциал, данной системы, В;
– стандартный электродный потенциал, данной системы, В;
R – универсальная газовая постоянная, R=8,314 Дж/(моль·К);
Т – температура по шкале Кельвина, К;
n – число электронов, участвующих в электродном процессе;
F – число Фарадея, F=96485 Кл/моль;
[Men+] – концентрация катионов металла в растворе, моль/л.
Потенциалы металлов, погруженных в растворы их солей с концентрацией 1 моль/л, называют стандартными электродными потенциалами. Значения стандартных электродных потенциалов различных металлов определяют по отношению к водородному электроду, потенциал которого условно принят равным нулю.
Ряд металлов, расположенных в порядке возрастания их стандартных электродных потенциалов, называют электрохимическим рядом напряжений или рядом стандартных электродных потенциалов:
Li, K, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Ni, Sn, Pb, H2, Cu, Hg, Ag, Pt, Au
· Чем левее в этом ряду стоит металл, тем выше его восстановительная способность, тем легче он окисляется.
· Каждый металл этого ряда способен вытеснять из растворов и расплавов солей все другие, стоящие правее его.
· Металлы, стоящие левее водорода (имеющие отрицательное значение стандартного электродного потенциала) способны вытеснять его из разбавленных кислот (кроме азотной).
· Металлы, стоящие до Mg, могут вытеснять водород из воды.
· Чем дальше друг от друга в ряду напряжений расположены два металла, тем большую Э.Д.С. может дать составленный из них гальванический элемент.
Гальванический элемент - это устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в электрическую. Гальванический элемент состоит из двух полуэлементов, каждый из которых представляет собой металлический электрод, погруженный в раствор соли того же металла. Полуэлементы соединяются в электрическую цепь с помощью трубки, заполненной токопроводящим раствором (так называемого солевого мостика).
Примером гальванического элемента может служить гальванический элемент Якоби-Даниэля. Электрохимическая схема этого элемента записывается в таком виде:
A (-) Zn / Zn2+ // Cu2+ / Cu (+) K
Реакция, протекающая на левом электроде, соответствует процессу окисления: Zn0 –2e → Zn2+
Электрод называется анодом, а процесс анодным. Анод обладает меньшим значением электродного потенциала (φ0= -0,76В). Реакция, протекающая на правом электроде, соответствует процессу восстановления:
Cu2+ + 2e → Cu0
Электрод называется катодом, а процесс катодным. Катод обладает большим значением электродного потенциала (φ0= +0,34В).
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (Э.Д.С.) элемента. Она равна разности потенциалов катода (более положительного электрода) и анода (менее положительного электрода):
Е= φCu- φZn = 0,34 - (-0,76) =1,1В
Электролизом называется совокупность окислительно-восстановительных процессов, протекающих на электродах при прохождении электрического тока через раствор или расплав электролита.
На электроде, подключенном к отрицательному полюсу внешнего источника тока (катоде), идет процесс восстановления. На электроде, подключенном к положительному полюсу источника тока (аноде), идет процесс окисления. На характер и течение электродных процессов при электролизе большое влияние оказывают состав электролита, природа растворителя, материал электродов и режим электролиза (напряжение, плотность тока, температура).
При электролизе водных растворов электролитов в растворе находятся ионы растворенного вещества и молекулы воды, которые также могут подвергаться электрохимическому окислению и восстановлению. Характер электрохимических процессов, протекающих на электродах, зависит от относительных значений электродных потенциалов соответствующих электрохимических систем. Из нескольких возможных процессов будет протекать тот, осуществление которого сопряжено с минимальной затратой энергии.
 2015-04-20
2015-04-20 1203
1203
