Для алкадиенов этого типа характерны те же свойства, что и для алкенов, поскольку взаимное влияние двойных связей на расстоянии, более чем две С–С-связи пренебрежимо на фоне влияния ближнего структурного окружения двойной связи.
Лекция №15
АЛКИНЫ
План.
- Изомеризация и номенклатура.
- Методы синтеза.
- Структура и физические свойства.
- Химические свойства.
Алкины – углеводороды ациклического ряда, содержащие в своей структуре два атома углерода, связанные между собой тремя связями, а оставшиеся валентности этих атомов могут быть затрачены на образование связей с другими атомами углерода или атомами водорода.
Алкины образуют гомологический ряд соединений, выраженных общей формулой СnH2n-2. Первый член гомологического ряда – этин или ацетилен.
Изомерия и номенклатура
Согласно IUPAC названия алкинов образуют, заменяя в названиях алканов суффикс “-ан” на “-ин”. В качестве родоначальной структуры выбирают самую длинную цепь, содержащую тройную связь. Нумерацию этой цепи начинают с того конца, к которому ближе находится тройная связь.
Примеры
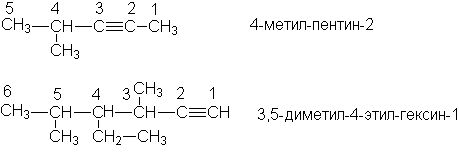
Названия остатков алкинов образуют, присоединяя суффикс –ил к названию алкина:
HCº C- этинил
СН3-Сº С- пропинил-1
НСº С-СН2- пропинил-2.
В рациональной номенклатуре замещенные алкины рассматриваются как производные ацетилена:
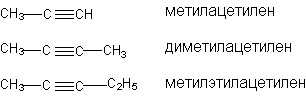
Структурная изомерия начинается с 4-го “С”, изомерия, связанная с изомерией углеродного скелета начиная с 5 “С”. По числу изомеров ацетиленовые углеводороды занимают промежуточное положение между алканами и алкенами.
Методы синтеза алкинов
- Реакции пиролиза метана или этана
2CH4 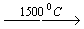 C2H2 + 3H2
C2H2 + 3H2
CH3 - CH3 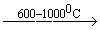 C2H2 + 2H2
C2H2 + 2H2
При пиролизе метана необходимо строго выдерживать время реакции. Для этого используется “закалка” - быстрый ввод на выходе реакционной зоны воды.
- Карбидный метод
CaC2 + 2H2O ® C2H2 + Ca(OH)2
Аналогично реагируют карбиды стронция и бария SrC2, BaC2.
Карбид магния с водой образует пропин
Mg2C3 +4 H2O ® CH3C º CH + 2Mg(OH)2
- Реакции нуклеофильного отщепления дигалогеналканов и моногалогеналкенов.
CH3-CHBr-CH2Br + 2NaOH 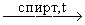 CH3-Cº CH + 2NaBr + 2H2O
CH3-Cº CH + 2NaBr + 2H2O
CH3-BrC=CH2 + NaOH 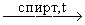 CH3-Cº CH + NaBr + H2O
CH3-Cº CH + NaBr + H2O
- Алкилирование алкинов.
Реакции проводятся через синтез ацетиленидов
а) R-Cº CH + NaNH2® R-Cº C-Na+ + NH3
R-Cº CNa + R'Hal ® RCº CR' + NaHal
б) R-Cº C-H +CH3-MgHal ® R-Cº C-MgHal + CH4
R-Cº C-MgHal + R’Hal ® R-Cº C-R’ + MgHal2
Физические свойства алкинов и природа связей
Алкины представляют собой бесцветные газы или жидкости. Начиная с С17, алкины являются кристаллическими веществами.
Тройная связь представляет собой одну s -связь С-С и две p -связи. При переходе от двойной к тройной связи средняя энергия p -связи снижается. Это означает, что тройная связь менее стабильна, чем двойная. Сам ацетилен неустойчивое соединение и способен к спонтанному взрывному распаду на элементы. Молекула ацетилена имеет линейное строение, что обусловлено sp-состоянием атомов углерода. Тройная связь в алкинах характеризуется более высокой поляризуемостью, чем в алкенах RCº C= 5,96; RC=C=4,17.
По сравнению с алкенами алкины характеризуются большими значениями потенциалов ионизации. Это означает, что электрон на ВЗМО у ацетилена связан прочнее чем у этилена. Это обусловливает более высокую электрофильность алкенов по сравнению с алкинами. Потенциал ионизации алкинов резко снижается при введении в них алкильных групп.
В электронных спектрах поглощения алкины имеют полосу поглощения при 170-180 нм, что соответствует p - p * - переходу. В ИК спектрах характерны валентные колебания связи Сº С при 2100-2260 см-1 и связи º С-Н при 3270-3330 см-1.
В спектрах ПМР химический сдвиг атома водорода º С-Н равен 1,7-2 м.д.
Химические свойства алкинов.
Высокая степень ненасыщенности алкинов обусловливает их склонность к реакциям присоединения. В реакциях электрофильного присоединения алкины менее реакционноспособны по сравнению с алкенами, несмотря на то что энергия p -связей у последних выше. Это обусловлено более высокой электрофильностью алкенов. В то же время в реакциях, имеющих гомолитический характер, например, каталитическое гидрирование, большую реакционную способность обнаруживают алкены.
- Реакция гидрирования.
Реакция имеет ступенчатый характер:
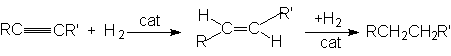
Сat: металлические Ni, Pl, Pd.
На первой стадии количественно образуется алкен, и после практического исчерпывания алкина начинается гидрирование алкена. Это связано с более высоким сродством алкинов к поверхности катализатора. Обычно реакция протекает нестереоселективно и образуется смесь цис- и транс-продуктов присоединения.
Модификация катализаторов приводит к стереоселективному синтезу. Так, промотируя палладий оксидом свинца (II) и CaCO3, получают катализатор Линдлара, на котором осуществляется стереоспецифичный синтез цис-изомера.
| RCºCR' + 2H2 | ® | RCH=CHR' |
| цис-алкен |
К аналогичным результатам приводит катализатор Pd/BaSO4 в пиридине.
Стереоселективное восстановление тройной связи можно осуществлять, используя для этого соответствующие агенты. К этим реакциям относятся:
а) восстановление натрием или литием в жидком аммиаке или этиламине. При этом преимущественно образуется транс-изомер:
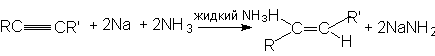
б) Гидроборирование. Алкины, подобно алкена, реагируют с гидридами бора, присоединяя их по тройной связи углерод-углерод
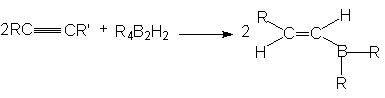
Первоначально образуется моноалкенильное производное бора, причем присоединение идет против правила Марковникова. Дальнейшее присоединение может происходить по двойной связи моноалкенильных производных бора. Однако если R2BH (или RBH2) содержит объемные группы, то пространственные препятствия затрудняют вторую реакцию присоединения и достигается высокий выход моноалкенильного производного.
Реакции такого типа особенно важны для синтезов, поскольку моноалкенильные производные бора могут быть окислены щелочным раствором Н2О2 в альдегиды (если в исходном алкине тройная связь находиться на конце цепи) или в кетоны (если тройная связь неконцевая)
2C4H9CºCH + R4B2H2 ® 2C4H9CH=CHB(R)2 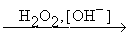 2C4H9CH=CH-OH ®
2C4H9CH=CH-OH ®
® 2C4H9CH2CHO
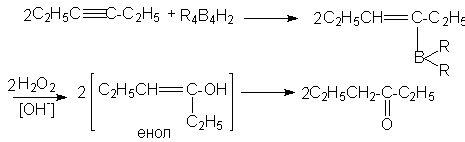
Моноалкенильные производные бора легко реагируют с уксусной кислотой в мягких условиях, образуя алкены. Весь этот процесс полностью стереоспецифичен, поскольку дизамещенные алкины дают только цис-алкены. Очевидно, что гидрид бора присоединяется к тройной связи цис-способом и образующийся моноалкенил бора реагирует далее с кислотой, образуя цис-алкен.
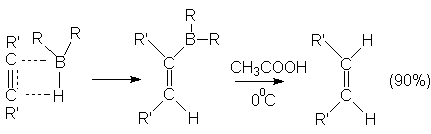
Реакции электрофильного присоединения.
- Присоединение галогенов (Cl2 и Br2)
Алкины, подобно алкенам, участвуют в реакциях присоединительного галогенирования. Отличие состоит лишь в том, что алкин можен присоединить две молекулы галогена, а алкен – только одну:
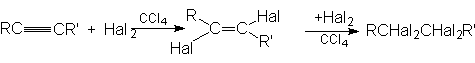
Промежуточный дигалогенид может быть получен присоединением одной молекулы галогена к алкину при низких температурах, причем реакция протекает преимущественно как транс-присоединение.
Реакции присоединения галогенов к алкинам как и другие реакции электрофильного присоединения, происходят медленнее, чем реакции присоединения к алкенам.
HCº C-CH2-CH=CH2  HCº C-CH2-CHBr-CH2Br (90%)
HCº C-CH2-CHBr-CH2Br (90%)
Такое соотношение реакционных способностей связано с различием устойчивости карбкатионов, образующихся при присоединении электрофильного реагента к кратным связям
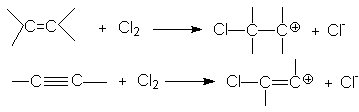
Можно видеть, что винил-катион менее устойчив по сравнению с алкил-катионом, поэтому образование последнего характеризуется более низким энергетическим барьером. В целом механизм галогенирования алкина (на примере бромирования) может быть представлен следующими стадиями:
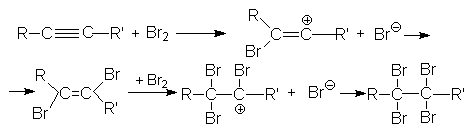
2. Присоединение галогеноводородов к алкинам.
Присоединение хлоро- и бромоводорода к алкинам протекает также, как и к алкенам. Реакция имеет ступенчатый характер.
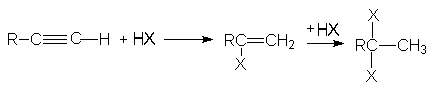
Обе реакции идут по правилу Марковникова. Показано, что присоединение галогеноводородов к алкинам идет как транс-присоединение. Поскольку реакционная способность тройной связи меньше чем у алкенов, используют катализ: например HgCl2.
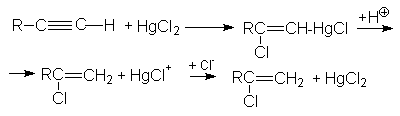
3. Реакция гидратации (Реакция Кучерова)
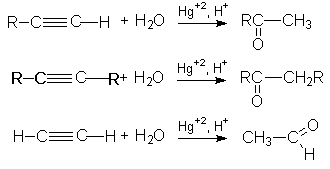
Механизм этой реакции можно представить последовательностью стадий:
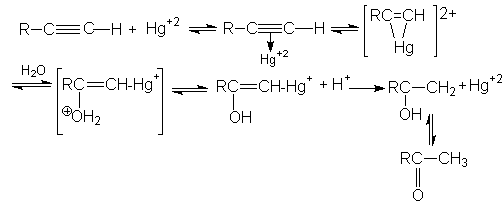
При синтезе ацетальдегида протекают побочные реакции:
а) альдольная конденсация
CH3CHO+CH3CHO 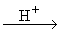 CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO 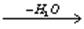 CH3CH=CH-CHO
CH3CH=CH-CHO 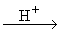 альдегидные смолы
альдегидные смолы
б) окисление
СH3CHO + 2Hg2+ 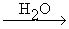 2Hg+ + CH3COOH + 2H+
2Hg+ + CH3COOH + 2H+
CH3CHO + Hg+ 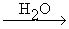 Hg + CH3COOH + 2H+
Hg + CH3COOH + 2H+
Подавление приведенных побочных реакций можно обеспечить путем увеличения скорости подачи ацетилена в реакционную зону. Благодаря этому образующийся альдегид отдувается из реакционной массы и степень его вовлечения в побочные реакции резко снижается.
4. Присоединение HCN.
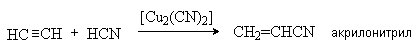
5. Присоединение спиртов.
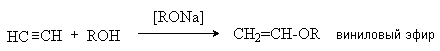
Кислотные свойства ацетилена и алкинов
с терминальной тройной связью.
Соединения этого типа являются С-Н – кислотами. Атом водорода, находящийся при углероде тройной связи обладает большей кислотностью, чем атом водорода алкенов и алканов. Объясняется это тем, что атомы Сº обладают большим s-характером и поэтому сильнее притягивают электроны, поэтому С-Н связи поляризованы и электроположительные атомы водорода в них проявляют большую кислотность. Кислотность ацетилена и a -алкинов проявляется в следующих реакциях:
RCº CH + K+NH2- 
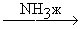 RCº C-K+ + NH3
RCº C-K+ + NH3
Амид-анион обладает высокой основностью, что обусловливает сдвиг равновесия в сторону образования ацетиленида. В то же время, вода, обладая более высокой кислотностью по сравнению с ацетиленом, вытесняет последний из ацетиленидов:
RCº CК + H2O ® RCº CH + КOH
Натриевые, калиевые и другие ацетилениды щелочных металлов являются истинными солями, состоящие из катиона металла и ацетиленид-анионов. Соли ацетиленов с тяжелыми металлами (Ag, Cu, Hg) – не в полном смысле соли. Это ковалентно-построенные соединения, нерастворимые в воде. Они осаждаются из водного раствора.
Осаждением ацетиленида серебра определяют наличие тройной связи или отделяют терминальные ацетилены от дизамещенных:
RCº CH + [Ag(NH3)2]NO3® RCº CAg + NH4NO3 + NH3
RCº CR' + [Ag(NH3)2]NO3 ® реакция не идет
Монозамещенные ацетилены тяжелых металлов легко регенерируют из осадка под действием сильных минеральных кислот.
RCº CAg + HNO3 ® RCº CH + AgNO3
Аналогичное использование находят ацетилениды меди
RCºCH + [Cu(NH3)2]Cl ® RCºC-Cu¯ + NH4Cl + NH3
RCºC-Cu + HCl ® RCºCH + CuCl
Ацетилениды магния (реактив) имеют важное синтетическое значение. Их получают действием терминального алкина на магний органические соединения с предельными радикалами:
RCºCH + CH3MgI ® CH4 + RCºC-MgI
Благодаря этому реактиву можно получать спирты и карбоновые кислоты, содержащую тройную связь:
а) RCºC-MgI + CH2=O ® RCºC-CH2-OMgI 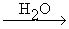 RCºC-CH2OH + Mg(OH)I
RCºC-CH2OH + Mg(OH)I
первичный спирт
б)
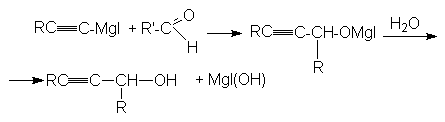
вторичный спирт
в)
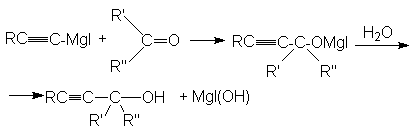
третичный спирт
г)
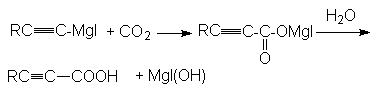
карбоновая кислота
Подобные синтезы можно осуществлять путем конденсации ацетилена или терминальных алкинов с альдегидами и кетонами (Фаворский)
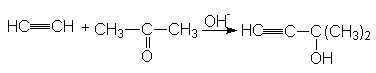
Механизм:
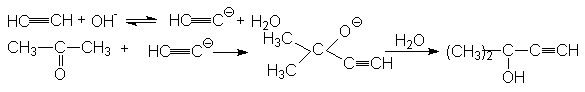
+ OH-
Конденсация ацетилена с альдегидами в присутствии щелочей не дает желаемого результата из-за побочной реакции альдольной конденсации. В.Реппе осуществил ее разработав новый катализатор на основе ацетиленида меди, стабилизированного соединениями висмута:
СHº CH + CH2O ® CHº CH-CH2OH 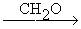 HO-CH2-Cº C-CH2-OH
HO-CH2-Cº C-CH2-OH
(бутиндиол-1,4)
Изомеризация алкинов
Алкины способны к изомеризации с перемещением кратной связи или с превращением в диеновые углеводороды.
Под действие щелочных металлов тройная связь переходит на конец молекулы полученного ацетиленида. Действие спиртовых щелочей способствует переходу тройной связи с конца молекулы в центр. Промежуточными продуктами в этих превращениях являются алленовые углеводороды (Фаворский)
CH3CH2CºCH 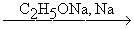 CH3CºCCH3
CH3CºCCH3
Окисление
RCº CR' + KMnO4  RCOOH + R'COOH
RCOOH + R'COOH
RCºCH 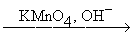 RCOOH + CO2
RCOOH + CO2
RCºCR' 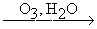 RCOOH + R'COOH
RCOOH + R'COOH
Окислительная конденсация терминальных алкинов.
2RCºCH 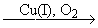 RCºC-CºCR
RCºC-CºCR
Полимеризация
1) Реакция Зелинского:
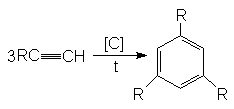
2) Димеризация:
2HCºCH 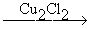 HCºC-CH=CH2
HCºC-CH=CH2 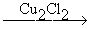 H2C=CH-CºC-CH=CH2
H2C=CH-CºC-CH=CH2
винилацетилен дивинилацетилен
Карбонилирование (Реппе)
CHºCH + CO + H2O ® CH2=CH-COOH акриловая кислота
CHºCH + CO + ROH ® CH2=CH-COOR эфир акриловой кислоты
CHºCH + CO + NH3® CH2=CH-CONH2 амид акриловой кислоты
Катализаторами этих реакций являются карбонилы никеля и кобальта.
 2015-04-23
2015-04-23 3664
3664








