Неподеленная электронная пара на кислородном атоме гидроксильной группы обуславливает возможность взаимодействия его с электрофильными реагентами с образованием донорно-акцепторной связи, при этом кислородный атом приобретает положительный заряд и образуются оксониевые соединения:
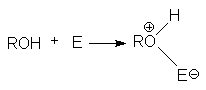
где E - кислота Льюиса, например BF3, AlCl3, PCl3, SOCl2, TiCl4, SnCl4, H+, NO2 и др.
Алканолы являются слабыми основаниями
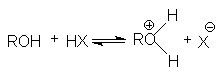
В присутствии сильных концентрированных кислот равновесие в достаточной степени смещено в правую сторону.
Последняя реакция обусловливает легкое отщепление уходящей группы, H2O, и это создает благоприятные условия для реакции нуклеофильного замещения, например, при синтезе простых эфиров.
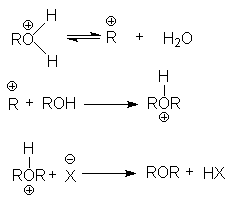
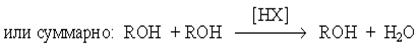
при замещении гидроксильной группы на галоген или другой кислотный остаток
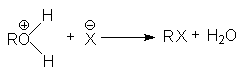
или суммарно:
ROH + HX ® RX + H2O
при алкилировании аренов спиртами
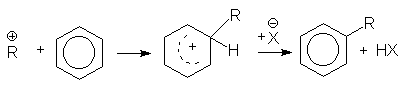
или суммарно:
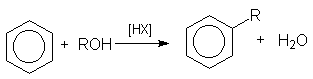
в реакции дегидратации спиртов
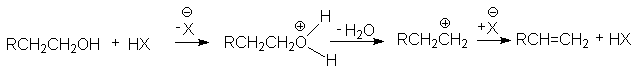
в различных перегруппировках, связанных с перегруппировками карбкатиона
а) миграция алкильных групп
б) миграция водорода
в) аллильная перегруппировка
(Подробно о перегруппировках а), б) и в) см. лекцию №23)
г) ретропинаколиновая перегруппировка
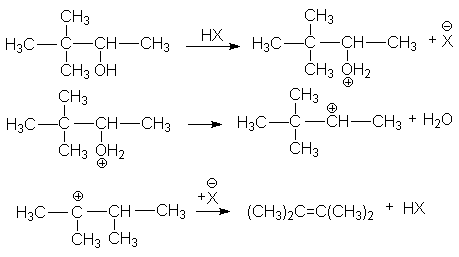
или суммарно:
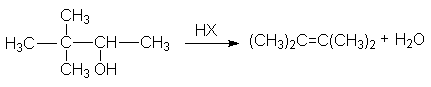
 2015-04-23
2015-04-23 343
343







