Алифатические амины являются одними из самых сильных незаряженных оснований (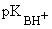 ~ 10 - 11). Их водные растворы имеют щелочную реакцию.
~ 10 - 11). Их водные растворы имеют щелочную реакцию.
R3N + H2O = R3NH+ + OH -
С неорганическими кислотами амины образуют соли, которые в большинстве случаев хорошо растворимы в воде.
R3N + HX = R3N+X -
Основность аминов зависит от их строения и природы растворителя. Сравнение основности в водных растворах показывает, что алкиламины являются более сильными основаниями, чем аммиак. Вторичные амины превосходят по основности первичные. Такой ряд основности согласуется с электронодонорным влиянием алкильных групп (+I-эффект), которое способствует делокализации положительного заряда в сопряженной кислоте (ионе аммония) и тем самым стабилизирует её в большей степени, чем свободный амин. Однако это не объясняет уменьшения основности при переходе от вторичных аминов к третичным.
| NH3 | C2H5NH2 | (C2H5)2NH | (C2H5)3N | |
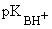
| 9,25 | 10,80 | 11,09 | 10,85 |
Вероятно, такое снижение основности связано с сольватацией. Сольватация молекулами воды триалкиламмониевого катиона затруднена присутствием трех гидрофобных алкильных групп и снижением возможности образования водородных связей.

Это предположение подтверждается тем, что в газовой фазе и в малополярных растворителях третичные амины превосходят по основности вторичные.
 2015-04-23
2015-04-23 449
449








