Известно, что альдегиды способны присоединять спирты с образованием
полуацеталей:
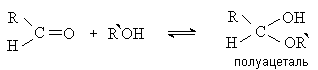
Карбонильная и гидроксильная группы
моносахаридов взаимодействуют внутримолекулярно с образованием циклического
полуацеталя:
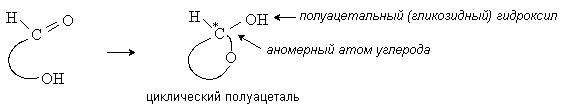
При этом возникает новый хиральный центр –
бывший карбонильный, а теперь аномерный атом углерода. Наиболее устойчивы
циклические полуацетали, содержащие шестичленный (пиранозный) или
пятичленный (фуранозный) циклы. Они образуются при взаимодействии
альдегидной группы с гидроксильной группой в положении 5 или 4 моносахарида
соответственно. На рисунке представлена схема образования циклических форм
D-глюкозы:
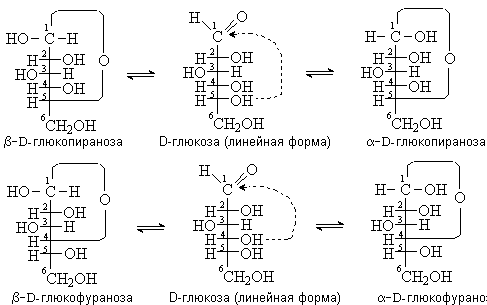
Возникновение нового хирального центра приводит
к появлению 2-х стереоизомеров для каждой из циклической форм - a- и b- аномеров.
Аномеры – это эпимеры, которые различаются по
конфигурации аномерного атома углерода.
У a-аномера
конфигурация аномерного центра совпадает с конфигурацией концевого хирального
атома С, у b-аномера она противоположна.
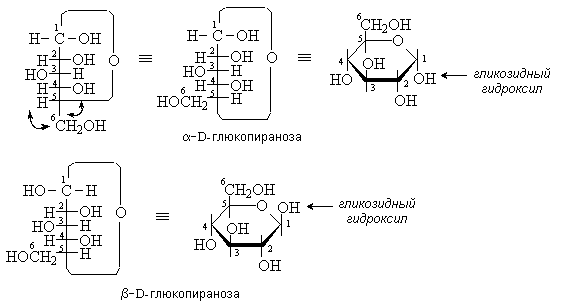
Циклические формы моносахаридов изображают с
помощью формул Хеуорса. Молекулу представляют в виде плоского цикла,
перпендикулярного плоскости рисунка. Заместители, находившиеся в формуле Фишера
слева, располагают над плоскостью цикла, справа – под плоскостью. Для
определения положения группы СН2ОН в формуле Фишера предварительно делают две
перестановки.
В кристаллическом состоянии моносахариды
находятся в одной из циклических форм. При растворении образуется равновесная
смесь линейной и циклических форм. Их относительное содержание определяется
термодинамической стабильностью. Циклические, особенно пиранозные формы,
энергетически более выгодны для большинства моносахаридов. Например, в растворе
D-глюкозы преобладает b-D-глюкопираноза:
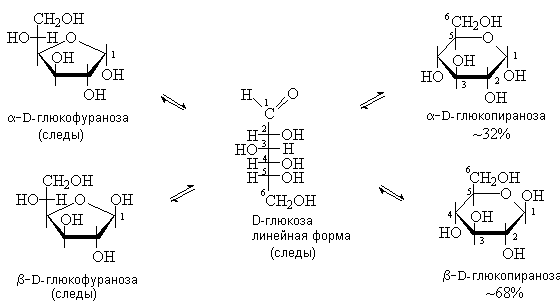
Существование равновесия между линейной и
циклическими формами моносахаридов получило название цикло-оксо-таутомерии.
Растворение кристаллического моносахарида
сопровождается постепенным таутомерным превращением, которое заканчивается
установлением таутомерного равновесия. Каждая таутомерная форма оптически
активна и имеет свою величину удельного вращения. Поэтому за таутомерным
превращением можно следить по изменению удельного вращения раствора, которое
заканчивается с установлением равновесия. Явление изменения удельного вращения
свежеприготовленного раствора моносахарида называют мутаротацией. Явление
мутаротации – одно из доказательств существования цикло-оксо-таутомерии у
моносахаридов.
Конформационное
строение
Формулы Фишера и Хеуорса являются условным
изображением пространственного строения моносахаридов. Близкое к действительному
расположение атомов в пространстве отражают конформационные
формулы.
Шестичленный цикл, в котором атомы находятся в
состоянии sp3-гибридизации, не
может иметь плоскую конформацию, так как это означало бы слишком сильное
искажение валентных углов (1200 вместо 1090) и заслоненное
положение заместителей. Наиболее выгодной конформацией для большинства
шестичленных циклов является конформация "кресла”, в которой все валентные углы
равны 1090 и нет заслоненных
положений заместителей. Так, у циклогексана есть две энергетически равноценные
конформации "кресла”, которые находятся в равновесии. Взаимопревращения между
ними называют инверсией цикла.
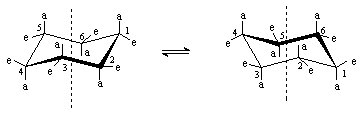
Заместители у каждого атома цикла могут
находиться в аксиальном (а) или экваториальном (е) положениях. Аксиальные связи расположены параллельно оси симметрии цикла и направлены
попеременно вверх и вниз. Экваториальные связи ориентированы под углом
1090 к оси симметрии цикла также
попеременно вверх и вниз. При инверсии цикла экваториальные связи становятся
аксиальными и наоборот.
При введении в циклогексан заместителей две
конформации кресла становятся энергетически неравноценными. Меньшей энергией,
как правило, обладает та конформация, в которой объемистые заместители занимают
экваториальное положение. Например, для циклогексанола наиболее выгодной
является конформация с экваториальным положением ОН группы:
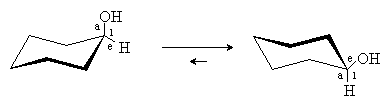
Основой строения пиранозных форм моносахаридов
является тетрагидропиран, для которого возможны две энергетически
неравноценные конформации кресла.
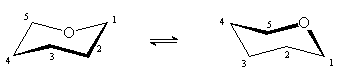
| 1С4 | 4С1 |
Более стабильной является конформация с
наименьшим числом объемистых заместителей в аксиальном положении. Для
большинства D-альдогексоз это конформация 4С1, в
которой группа CH2OH занимает
экваториальное положение.
Рассмотрим конформационное строение b-D-глюкопиранозы.
Более выгодной для этой формы D-глюкозы является конформация 4С1, в которой все заместители находятся в экваториальном
положении.
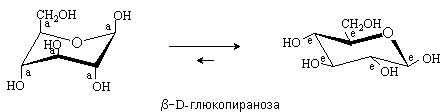
У a-аномера гликозидный гидроксил в этой конформации будет
занимать аксиальное положение. Поэтому в равновесной смеси таутомеров D-глюкозы
преобладает b-аномер.
b-D-глюкопираноза – единственная D-гексоза с
экваториальным положением всех заместителей. Как следствие этого, D-глюкоза -
наиболее распространенный в природе моносахарид. Из всего семейства
D-альдогексоз в природе встречаются только эпимеры D-глюкозы – D-галактоза и
D-манноза, у которых число заместителей, занимающих аксиальное положение
минимально.
1.2. Химические
свойства
Химические свойства моносахаридов определяются
наличием карбонильной группы (в ациклической форме), полуацетального гидроксила
(в циклических формах) и спиртовых ОН групп.
 2015-04-23
2015-04-23 5024
5024








