Если разные газы находятся в одном и том же сосуде, то общее давление равно сумме парциальных давлений, которые производили бы эти газы в отдельности, если бы занимали весь сосуд, т. е.
Робщ = Р1 + Р2 + Р3 +... Рn
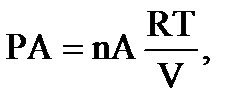
Если nА молей газа А находятся в объеме V при температуре Т, то давление будет равно:
где R – объем, занимаемый 1 молем газа при 0 градусов по Цельсию и атмосферном давлении, принятом за 1.
Соответственно:
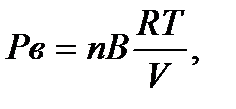
следовательно:
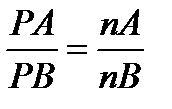
Например: если в сухом воздухе кислород составляет 20,93% молекул, то:
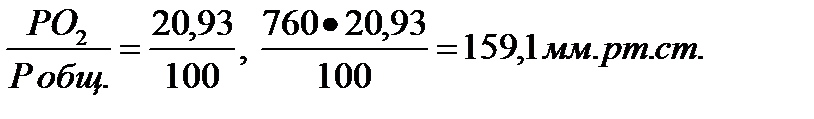
Таким образом, парциальное давление кислорода при давлении 760 мм. рт. ст. равно 159,1 мм. рт. ст.
На границе раздела между газом и жидкостью, возникающей, например, в результате введения жидкости в вакуум, количество молекул жидкости, обладающих достаточной кинетической энергией для испарения (в секунду на единицу поверхности жидкой фазы), пропорционально температуре жидкости. Из газовой фазы в жидкую будет возвращаться такое количество молекул, которое сталкивается в секунду с единицей поверхности жидкости. При постоянной температуре это количество пропорционально давлению пара.
Скорость испарения равна скорости конденсации пара в точке равновесия. Следовательно, давление пара определяется температурой. Если между жидкостью и газом (или газами), например, воздухом, существует поверхность раздела, то устанавливается равновесие. Тогда по закону Дальтона: Робщ = парциальное давление каждого газа + парциальное давление жидкости в газовой фазе. В физиологической практике второй член уравнения соответствует давлению водяного пара. Воздух будет насыщен водяным паром, если парциальное давление последнего максимально для данной температуры.
 2015-04-23
2015-04-23 939
939







