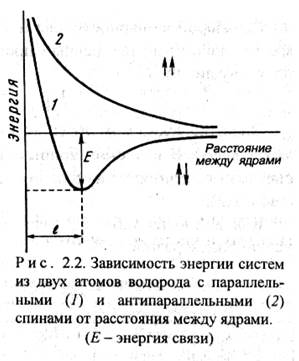
Метод валентных связей впервые был использован в 1927 г. немецкими учеными В. Гейтлером и Ф. Лондоном, которые провели квантово-механический расчет молекулы водорода. В методе ВС предполагается, что атомы в молекуле сохраняют свою индивидуальность. Электронная пара заселяет орбиталь то одного, то другого атома. Гейтлер и Лондон показали, что при сближении двух атомов водорода с антипараллельными спинами происходит уменьшение энергии системы (кривая 1), что обусловлено увеличением электронной плотности в пространстве между ядрами взаимодействующих атомов. Рассчитанная ими энергия связи отличалась от экспериментальной не более, чем на 10%. При сближении атомов с параллельными спинами энергия системы возрастает (кривая 2) и молекула в этом случае не образуется.
Позднее метод ВС получил дальнейшее развитие и был распространен на другие молекулы. Метод ВС базируется на следующих основных положениях:
1. Химическая связь между двумя атомами возникает как результат перекрывания АО с образованием электронных пар (обобществление двух электронов);
|
|
|
2. Атомы, вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. Энергия обмена электронами между атомами (энергия притяжения атомов) вносит основной вклад в энергию химической связи. Дополнительный вклад в энергию связи дают кулоновские силы взаимодействия частиц;
3. В соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с антипараллельными спинами;
4. Хар-ки химической связи (энергия, длина, полярность и др.) определяются типом перекрывания АО.
Согласно теории ВС, ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов.
Следует отметить, что электронная структура молекулы значительно отличается от электронной структуры образующих ее атомов. Например, электронные орбитали в молекуле водорода не имеют сферической симметрии, как АО атомов водорода, так как электронная пара постоянно меняет свое положение относительно двух ядер в молекуле. Электронная пара в молекуле водорода находится на более низком энергетическом уровне, чем уровень электронов в атомах водорода.
Изменения претерпевает электронная структура внешних оболочек и подоболочек атомов, которая в основном и определяет природу и свойства атомов. Поэтому в образовавшейся молекуле атомы с исходной электронной структурой не существуют. У атомов в молекуле сохраняются лишь электронные конфигурации внутренних электронных оболочек, не перекрывающихсяпри образовании связей. Последнее дает удобную возможность говорить о том, что молекулы состоят из тех или иных атомов, ПР: молекула диоксида серы – из двух атомов кислорода и одного атома серы.
 |
 2015-04-30
2015-04-30 4164
4164







