Концепция гибридизации - это удобный описательный прием, который помогает нам описать эквива-лентные, определенным образом направленные связи, объективно существующие в природе.
Идея о гибридизации была выдвинута американским ученым Л. Полингом. Он исходил из того, что значения энергии Е для s- и р-орбиталей либо совпадает между собой (ПР: атом водорода и водородоподобные ионы), либо различаются ненамного. Тогда состояния валентных электронов описывается не чистыми s-, p-, d-орбиталями, а смешанными или гибридными волновыми функциями, которые представляют собой линейную комбинацию собственных функций, описывающих состояние исходных электронов. ПР: для возбужденного атома С вместо одного 2s- и трех 2р-состояний в результате гибридизации получаются 4 вырожденные гибридные орбитали, Е которых промежуточна м-у Е 2s- и 2р- орбиталей. Такая гибридизация наз тетраэдрической или sp3- гибридизацией.
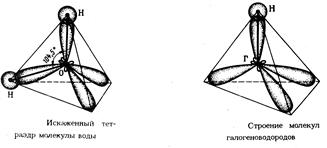
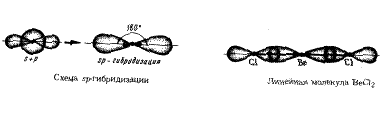
Т.о., число гибридных орбиталей всегда = суммарному числу исходных орбиталей. Кроме того, при возникновении гибридных орбиталей необходимо соблюдение следующих условий: 1) хорошее перекрывание гибридизуемых электронных орбиталей; 2) небольшая разница в энергиях атомных орбиталей, участвующих в гибридизации. ПР: 1s-орбитали не могут гибридизоваться с 2р-орбиталями, так как у них различные значения главного квантового числа, а потому их энергии сильно различаются. Гибридизация всегда сопровождается изменением формы электронного облака. При этом гибридное электронное облако асимметрично: имеет большую вытянутость по одну сторону от ядра, чем по другую. Поэтому хим. связи, образованные с участием гибридных орбиталей, обладают большей прочностью, чем связи за счет чистых негибридных электронных облаков. Гибридизация одной s-орбитали и одной р-орбтали приводит к возникновению двух гибридных облаков, расположенных под углом 180°. Это так называемая sp-гибридизация, в результате которой гибридные облака располагаются по прямой (ПР: BeCl2, CaCl2).
Комбинация одной s- и двух p-орбиталей приводит к возникновению трех асимметричных гибридных орбиталей, расположенных под углом 120°. Это sр2- гибридизация. Например, возбужденный атом бора подвергается sр2 -гибридизации, в результате ВС13 представляет равносторонний треугольник.
При spз-гибридизации четыре гибридных облака располагаются под тетраэдрическим углом 109° 28'. Этот угол является оптимальным, обеспечивающим максимальное взаимное удаление и минимальную энергию отталкивания асимметричных гибридных облаков своими утолщенными частями, что обеспечивает минимум энергии системы. Поэтому молекула CH4 представляет собой правильный тетраэдр, в центре которого находится атом углерода с четырьмя тетраэдрически направленными гибридными облаками. Четыре атома водорода занимают вершины тетраэдра, химические связи направлены к вершинам тетраэдра. Угол между связями равен точно тетраэдрическому.
В атомах с d-электронными орбиталями гибридизация приводит к образованию более сложных конфигураций электронных облаков. Гибридизация с участием f-электронных состояний пока еще почти не разработана.
Таблица 1. Пространственное расположение для различных типов гибридизации с участием s-, р-, d -орбиталей
| Тип гибридизации орбиталей центрального атома | Геометрическая модель гибридных орбиталей | Угол м-у связями, градус | Примеры |
| sp или dp | Прямая линия | ZnCl2, BeF2 | |
| sp2 , dp2 или sd2 | Плоский треугольник | BCl3, AlF3 | |
| pd2 | Тригональная пирамида | ||
| sp3 или sd3 | Тетраэдр | 109.28 | CH4, SiH4 |
| sp2dx –y (sp2d) | Квадрат | PdBr42- | |
| sp3dz или spd 3 | Тригональная бипирамида | 90 и 120 | PF5 |
| sp3dx –y (sp3d) | Квадратная пирамида | ||
| sp3dx –ydz (sp3d2) | Октаэдр | SF6, SbCl6 | |
| sp3dxydyz (sp3d2) | Тригональная призма | ||
| sp3dzdx-ydxy (sp2d3) | Пентагональная бипирамида | ||
| sp3d4 | Додекаэдр | Mo(CN)84- |
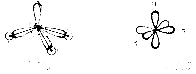
 | |||||||
 | |||||||
 | |||||||
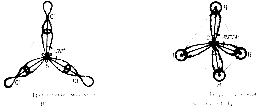 | |||||||
 2015-04-30
2015-04-30 3863
3863
