Большинство химических реакций обратимо, т.е. протекает одновременно в противоположных направлениях. Рассмотрим обратимую реакцию 2Н2(г) + О2(г) «2Н2О(г), DН<0 DS<0
Протекание ре акции в прямом направлении сопровождается выделением теплоты (DН<0). Энтропия системы при этом уменьшается (DS<0), так как в результате реакции на 3 моль газов образуются 2 моль газов. Таким образом, движущей силой этого процесса является энергетический (энтальпийный) фактор.
Протекание рассматриваемой реакции в обратном направлении сопровождается поглощением теплоты (DН>0); энтропия системывозрастает (DS>0). Таким образом, движущей силой этого процесса является энтропийный фактор.
Представим себе, что при 2000°С и 101,3 кПа в закрытый сосуд введена смесь водорода и кислорода. Происходит процесс образования паров воды. Его протекание обеспечивает энтальпийный фактор. Но с появлением паров воды начинает действовать энтропийный фактор — часть образовавшейся воды разлагается на водород и кислород. Вначале действие энтальпийного фактора преобладает над действием энтропийного фактора. Но в конце концов действие этих двух противоположно действующих факторов уравновешивается: DН=ТDS, т. е. DG=0. Наступает химическое равновесие. При химическом равновесии число образующихся в единицу времени молекул (или других частиц) при прямой реакции равно числу молекул (других частиц), вступивших во взаимодействие при обратной реакции, т. е. химическое равновесие является динамическим. В состоянии химического равновесия скорость прямой реакции равна скорости обратной реакции.
|
|
|
Т.о., вследствие обратимости процесса -полного превращения водорода и кислорода в воду не происходит: в результате взаимодействия в сосуде присутствует смесь всех трех газов — водорода, кислорода и воды. Это наблюдение можно обобщить: самопроизвольное протекание химических реакций происходит до известного предела — до установления в системе химического равновесия (DG=0). К равновесию можно подойти с противоположных сторон — как за счет взаимодействия исходных веществ, так и за счет взаимодействия конечных продуктов.
Константа химического равновесия зависит от природы реагентов и от температуры. Она связана с изменением стандартной энергии Гиббса химической реакции DG° уравнением DG° = -RT * ln K,
DG°298 = -5,71 lnK298
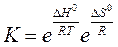 Приведенное уравнение позволяет по величине DG° вычислить К, а затем и равновесные концентрации (парциальные давления) реагентов. Большим отрицательным значениям DG (DG° <<0) отвечают большие значения K(K>>1), т. е. в равновесной смеси преобладают продукты взаимодействия. При больших положительных значениях DG(DG° >>0) в равновесной смеси преобладают исходные реагенты K(K<<1). Если учесть, что DG° = DH° - TDS°= -RT * ln K то после некоторого преобразования получим
Приведенное уравнение позволяет по величине DG° вычислить К, а затем и равновесные концентрации (парциальные давления) реагентов. Большим отрицательным значениям DG (DG° <<0) отвечают большие значения K(K>>1), т. е. в равновесной смеси преобладают продукты взаимодействия. При больших положительных значениях DG(DG° >>0) в равновесной смеси преобладают исходные реагенты K(K<<1). Если учесть, что DG° = DH° - TDS°= -RT * ln K то после некоторого преобразования получим
|
|
|
Из этого уравнения видно, что константа равновесия очень чувствительна к изменению температуры. Для эндотермических процессов повышение температуры отвечает увеличению константы равновесия, для экзотермических — ее уменьшению. От давления (если оно не очень велико) константа равновесия не зависит. Зависимость константы равновесия от энтальпийного и энтропийного факторов свидетельствует о влиянии на нее природы реагентов.
 2015-04-30
2015-04-30 781
781








