При проведении реакции при постоянной температуре (изотермический про-
цесс) степень превращения реагентов зависит от их концентрации и не зависит от температуры, поэтому уравнение материального баланса можно проинтегрировать и получить зависимость степени превращения от времени.
При не изотермическом проведении процесса (адиабатическом или программно регулируемом) приходится решать совместно уравнения материального и теплово-
го баланса с учетом зависимости скорости реакции от температуры и, при необхо-
димости, процесса теплопередачи.
Для создания приблизительно изотермических условий в реакторе можно применить несколько способов теплообмена:
- теплообмен при постоянной скорости теплопередачи; когда реактор обогревается топочными газами или пламенем, коэффициент теплопередачи изменяется мало, а температура настолько высока, что изменение температуры реагентов практически не влияет на температурный напор;
- теплообмен при постоянном коэффициенте теплопередачи; например, в аппаратах с мешалкой коэффициент теплопередачи зависит в основном от скорости перемешивания, которую можно держать постоянной, и скорость теплопередачи будет определяться изменением температуры реагентов;
- автоматическое регулирование скорости теплопередачи путем регулирования расхода теплоносителя или изменения температуры его фазового перехода, напри-
мер за счет давления.
Последний способ, в принципе, является самым лучшим, но не всегда экономически целесообразным.
Теплообмен в реакторах смешения. Рассмотрим химическую реакцию
А + В = К + ∆Нr
где ∆Нr - энтальпия реакции, Дж/моль.
Запишем уравнение теплового баланса, относя мольные энтальпии к некоторой температуре Tс, например 0°, являющейся уровнем отсчета.
Начальная температура реагентов T0, конечная - Т:
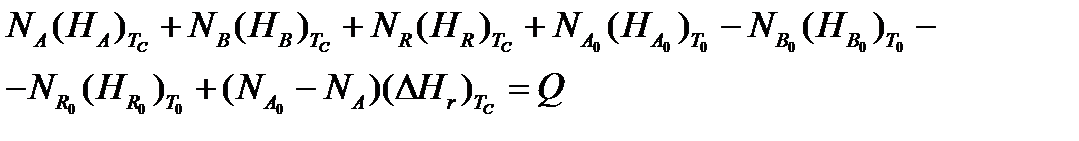
Q - количество отводимого или подводимого тепла, Дж.
Если отсутствуют фазовые превращения, то энтальпии компонентов можно выразить через теплоемкости:
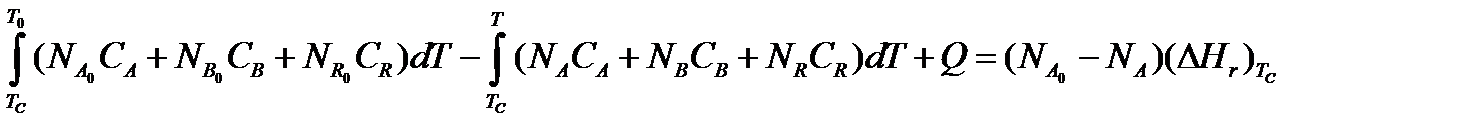
Если полагать, что теплоемкости не зависят от температуры в исследуемом интервале температур, а температура Т0 является уровнем отсчета, то уравнение упростится:
(NАСА + NВСВ + NRСR) (Т - Т0) + (NА0 - NА)(∆Нr)То = Q
Зная состав исходной смеси, можно связать степень превращения и температуру.
Для стехиометрической смеси, разделив последнее уравнение на NA0 получим:
[(1-ХA)(СA + СB) + ХAСR]∆Т = Q/NA0.
После преобразований, получим:
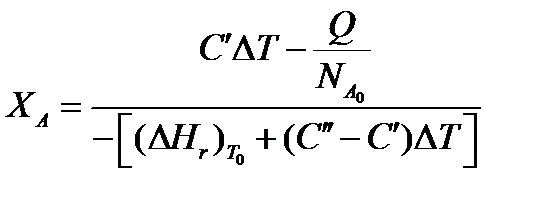
где С' и С" — сумма теплоемкостей реагентов и продуктов реакции соответствен но.
Но, так как (∆Нr)Т0 + (С' - С")∆Т = (∆Нr)Т,
то 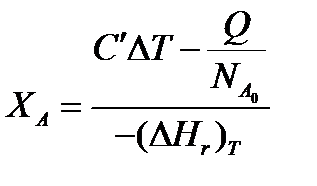
Здесь у энтальпии реакции и теплоты термодинамическое правило знаков, т.е. тепло, подводимое к системе, считается положительным. Для адиабатических условий Q=0, поэтому
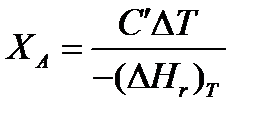
Пример 9.4. Для реакции первого порядка А + В = R, протекающей в адиабатических условиях, известны следующие данные: T0 = 28 °С; NA0 = NB0 = 1 кмоль;
NR0 = 0; СА = СВ= 125 Дж/(моль ∙ К); СR = 167 Дж/(моль∙К); Н= - 11600 Дж/моль. Константа скорости реакции в узком интервале температур зависит линейно от температуры: k = 4,4 + 0,08(T-28) ч-1. Определить степень превращения реагентов и время ее достижения, если температура в реакторе повысилась за счет реакции на 28 К.
Решение: Полагая отсутствие фазовых превращений в процессе, составим уравнение теплового баланса
[(1 - XA)(125 + 125) + 167XA] (T-28) – 11600XA = 0;
(250 – 83XA)(T - 28) = 11600XA; T - 28 = 28 = 11 600XA/(250 – 83XA); ХA = 0,503.
Определим время реакции из баланса массы при условии реакции первого порядка
τА = k(1-ХA).
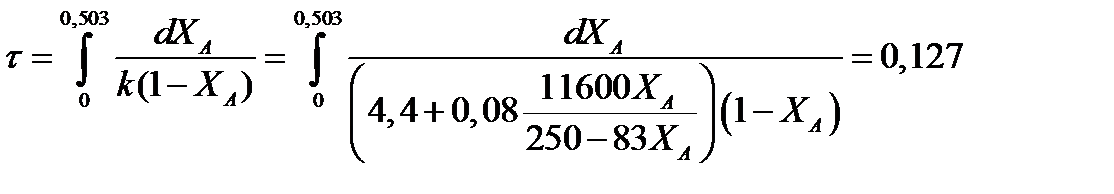
(Последний интеграл вычислен численным методом по формуле Симпсона.)
Составим тепловой баланс в дифференциальной форме, полагая, что за элементар-
ное время dτ скорость реакции rA и скорость теплопередачи R определяются урав-
нениями
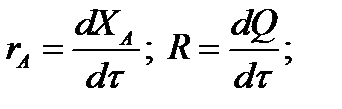
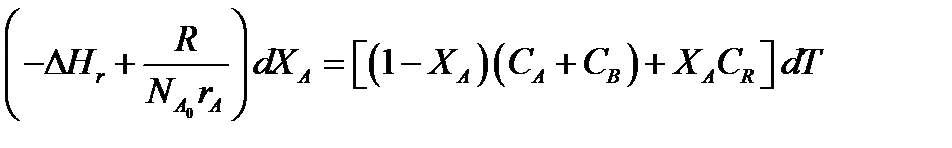
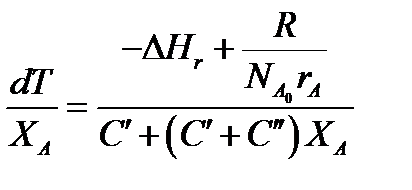
Теплоемкость и скорость реакции являются известными функциями температу-
ры. Если скорость теплопередачи задана в функции от температуры, то послед-
нее уравнение можно проинтегрировать. Для трех рассмотренных способов теп-
лообмена связь между температурой и скоростью теплопередачи имеет вид:
- теплообмен при постоянной скорости теплопередачи
R = соnst;
- теплообмен при постоянном коэффициенте теплопередачи
R = КS (Tт - Т), КS = соnst, Тт = соnst;
- автоматическое регулирование скорости теплопередачи
R= ∆Нr∙rА = КS(Тт - Т), T= const.
Здесь: К - коэффициент теплопередачи, Вт/(м2∙К); S - поверхность теплопереда-
чи, м2; Тт - температура теплоносителя.
Пример 9.5. Для реакции первого порядка известны следующие данные: энталь-
пия реакции ∆Нr = 11600 Дж/моль; константа скорости реакции k= 0,8 ч-1; коэф-
фициент теплопередачи К = 51 Вт/(м2∙К); начальная загрузка реагента
NА0 = 2270 моль. Определить поверхность теплообмена, необходимую для поддержания постоянной температуры t = 49 °С до конечной степени превращения XA = 70%. Нагрев осуществляется паром, температуру которого Tт можно регулировать в пределах от 110 до 177 °С.
Решение: Скорость подвода тепла должна быть наибольшей в начале процесса, когда ХА = 0, а скорость реакции — наибольшая. Расчет будем производить, используя уравнение
∆Нr∙rA=КS1(Тт-T)
Откуда максимальная поверхность теплопередачи в этот момент выразится урав
нением
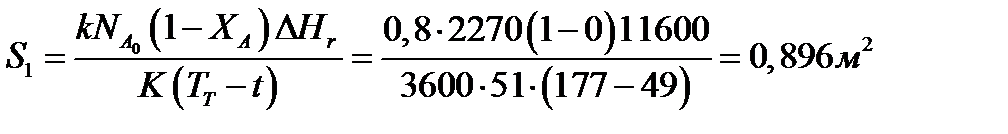
При такой поверхности и конечной степени превращения ХA = 0,7 температура теплоносителя должна быть равна
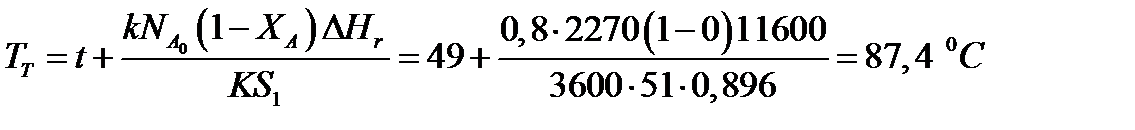
Эту температуру не обеспечить паром заданных параметров. Степень превраще-
ния, отвечающая наиболее низкой заданной температуре теплоносителя110 °С, при поверхности теплопередачи S1 составит
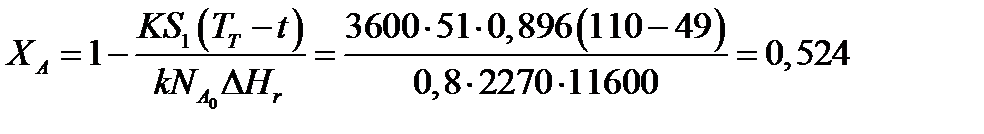
При температуре теплоносителя 110 °С и степени превращения 0,7 имеем
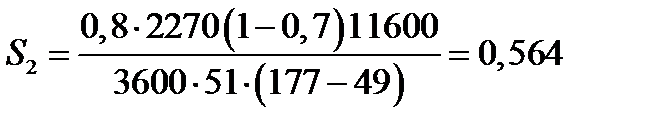 м2
м2
При ХА = 0,524 и S2 = 0,564 м2 имеем
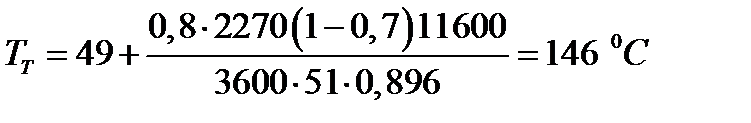
Таким образом, нагреватель должен состоять из двух параллельных змеевиков, один из которых с поверхностью S1 = 0,564 м2, а другой - S2 = 0,896 - 0,564 = 0,332 м2. При снижении температуры пара до 110 °С змеевик с поверхностью 0,332 м2 следует отключить.
Кривые регулирования строятся по уравнениям
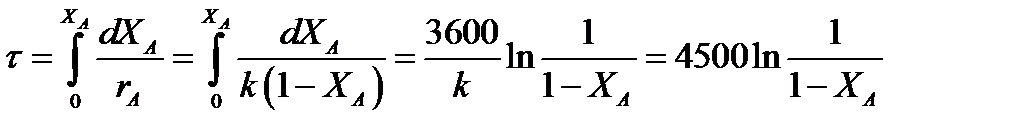
При XA ≤ 0,52 TТ = 49 + 128(1 - ХА); при ХА > 0,52 TT = 49 + 203(1-XA)
Теплообмен в реакторах вытеснения. Если полагать отсутствие в реакци-
онной зоне реактора идеального вытеснения радиальных градиентов температур, то можно составить три уравнения, одно из которых - баланс массы, второе - баланс тепла по реакционной массе и третье - баланс тепла по теплоносителю. Схема тепло - и массообмена в элементе реактора представлена на рис. 9.2.
Уравнение баланса массы
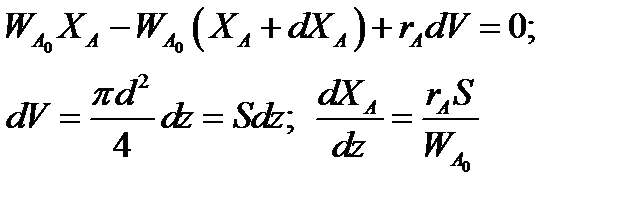
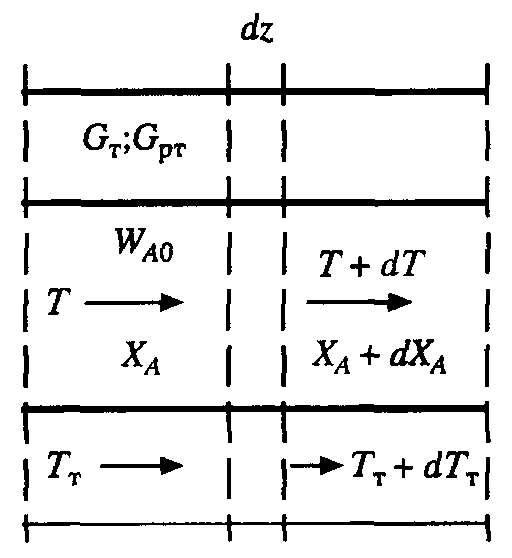 Рис.9.2 К расчёту теплообмена в реакторе вытеснения Рис.9.2 К расчёту теплообмена в реакторе вытеснения | Уравнение баланса тепла в элементе реакционной зоны 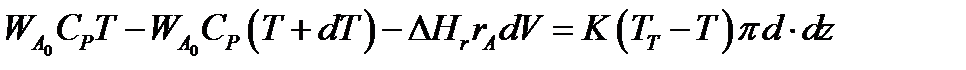 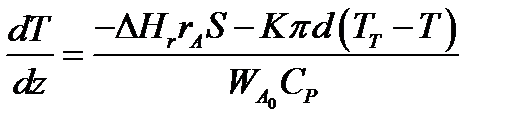 Уравнение баланса тепла в элементе рубашки Уравнение баланса тепла в элементе рубашки 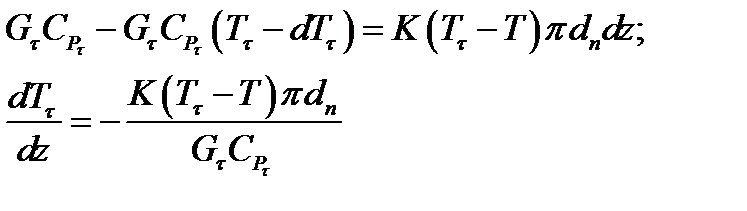 |
Совместное решение системы из трех дифференциальных уравнений дает возможность определить распределение степеней превращения, температур реакционной смеси и теплоносителя по длине реактора идеального вытеснения.
Для адиабатического реактора идеального вытеснения получаем систему из двух дифференциальных уравнений
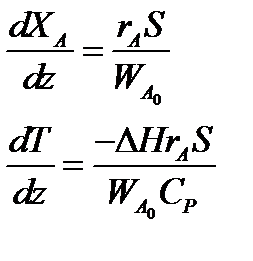
Пример 9.6. В гомогенном реакторе идеального вытеснения, представляющем собой трубу с внутренним диаметром 50 мм, протекает адиабатическая реакция второго порядка. Кинетические параметры реакции: энергия активации
Е = 58200 Дж/моль, k0 = 2∙107 м3/(моль∙ч). Начальная концентрация реагента
20 кмоль/м3, его мольный расход 60 кмоль/ч, теплоемкость реакционной смеси 125 Дж/(моль∙К). Энтальпия реакции ∆Нr = - 10000 Дж/моль. Определить длину реактора при 90%-ной степени превращения, если начальная температура реагентов 770C
Решение: Подставим исходные данные в систему дифференциальных уравнений материального и теплового баланса адиабатического реактора:
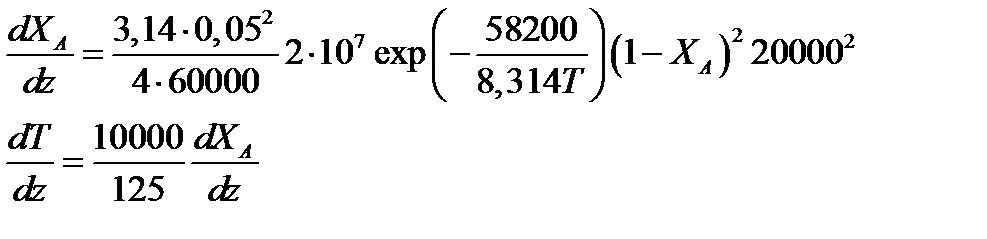
После преобразований получим:
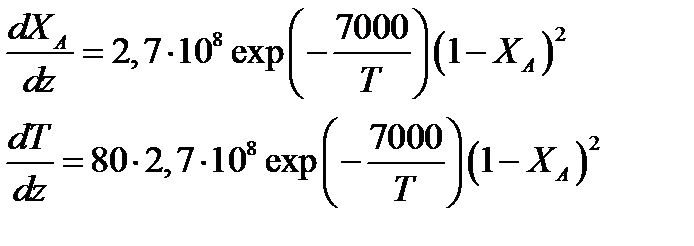
Решая полученную систему численным методом, можем найти длину реактора. Например, при решении модифицированным методом Эйлера при шаге интег-
рирования 0,2 м получаем длину реактора 1,3 м (см. табл. 9.6).
Таблица 9.6. Результаты решения дифференциального уравнения
| z, м | 0,0 | 0,2 | 0,4 | 0,6 | 0,8 | 1,0 | 1,2 | 1,3 |
| XA,% | 0,00 | 12,94 | 30,31 | 51,50 | 70,54 | 82,22 | 88,32 | 90,21 |
| T, K | 350,0 | 360,4 | 372,2 | 391,2 | 406,4 | 415,8 | 420,7 | 422,2 |
 2015-04-30
2015-04-30 3132
3132
