Катализируют реакции присоединения друг к другу двух молекул с образованием ковалент-ной связи. Этот процесс сопряжён с разрывом фосфоэфирной связи в молекуле АТФ (или других нуклеозидтрифосфатов) или с разрывом макроэргических связей других соединений. В первом случае (при использовании энергии гидролиза АТФ) такие ферменты называют ли-газами, или синтетазами (см. схему Г).
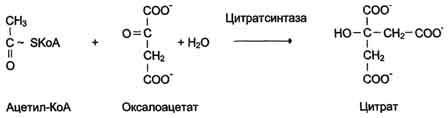
В случае, когда источником энергии служит любое другое макроэргическое соединение (не АТФ), ферменты называют синтазами (см. схему на с. 83).

Схема А
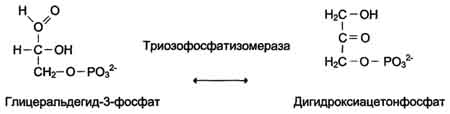
Схема Б
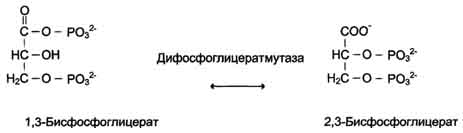
Схема В
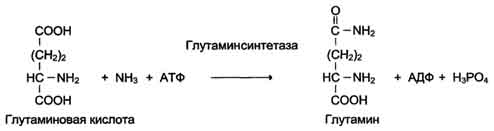
Схема Г
Схема
2. Сложность строения ферментов. Механизм ферментативного катализа
Сложность строения Ферменты по химической природе – этот белки. В отличие от белков у ферментов имеется активный центр (АЦ). АЦ – это уникальная для каждого фермента совокупность функциональных групп аминокислотных остатков, строго ориентированных в пространстве за счет третичной или четвертичной структуры фермента. В АЦ различают субстратный и каталитический участки. Субстратный – это «руки» фермента. Он обуславливает субстратную специфичность фермента, т.е. сродство фермента к субстрату. Субстрат - это вещество, на которое действует фермент. Раньше считали, что взаимодействие фермента и субстрата происходит по типу «ключ к замку», т.е. АЦ фермента должен точно соответствовать субстрату, как ключ к замку. Сейчас считается, что точного соответствия между ферментом и субстратом нет, оно возникает в процессе взаимодействия фермента с субстратом (теория вынужденного соответствия). Второй участок в АЦ – каталитический. Он обуславливает специфичность действия фермента, т.е. тип ускоряемой реакции.
По строению все ферменты можно разделить на однокомпонентные (простые, или ферменты-протеины) и двухкомпонентные (сложные, или ферменты-протеиды). Ферменты-протеины построены по типу простых белков – состоят только из аминокислот. Ферменты-протеиды состоят из белковой части – апофермента и небелковой части – кофермента. Апофермент обуславливает субстратную специфичность, т.е. играет роль субстратного участка АЦ, а кофермент играет роль каталитического участка АЦ, т.е. обуславливает специфичность действия. Коферментами могут быть металлы, витамины и другие небелковые низкомолекулярные вещества.
Некоторые ферменты, имеющие четвертичную структуру помимо АЦ могут иметь аллостерический центр. Он служит для регуляции активности ферментов.
3. Влияние температуры
Температура, при которой наблюдается максимальная активность ферментов, называется оптимальной. Для большинства ферментовоптимальной температурой является температура от +35С — +45С. Если фермент поместить в условия, ниже оптимальной температуры, будет происходить снижение его активности, такое состояние называется обратимой инактивацией фермента, т.к. если вновь поднять температуру до оптимальной, активность фермента возобновится. Если поместить фермент в условия, где температура будет выше оптимальной, то также будет прроисходить снижение его активности, но в данном случае необратимая инактивация, т.к. если понизить температуру до оптимальной, активность фермента не возобновится. Это объясняется тем, что высокая температура вызывает денатурацию молекулы фермента.
Влияние рН среды
рН среды влияет на заряд молекулы фермента, а значит на работу АЦ. Оптимальная рН для каждого фермента своя, но для большинства ферментов от 4 до 7. Например, для альфа-амилазы слюны опт.рН равна 6,8. Имеются исключения, например, для пепсина опт.рН равна 1,5-2,0; для трипсина и химотрипсина опт.рН равна 8-9.
4,5. Активация ферментов. Активация ферментов – это увеличение скоро-
сти биохимической реакции в результате действия модификатора. Модифика-
торами могут выступать соединения различной природы: коферменты, ионы
металлов и субстраты. Кофакторы являются не только структурными элемен-
тами ферментов, но и их активаторами. Активация кофакторами объясняется
спецификой их участия в связывании субстрата, и, собственно, в катализе. Осо-
бенно заметно активирующее влияние кофакторов при действии на фермент,
который не насыщен кофакторами.
Ионы металлов являются довольно специфичными активаторами. Часто
для некоторых ферментов требуются ионы не одного, а нескольких металлов.
Например, для фермента Na+, K+
-АТФаза, который осуществляет перенос одно-
зарядных катионов через клеточные мембраны, в качестве активаторов необхо-
димы ионы магния, натрия и калия. Активация ионами металлов осуществляет-
ся по разным механизмам. В некоторых ферментах они входят в состав катали-
тического участка. В ряде случаев ионы металлов облегчают присоединение
субстрата к активному центру фермента за счет образования дополнительных
связей. Иногда ион металла соединяется с субстратом, образуя своеобразный
металлосубстратный комплекс, который предпочтителен для действия фермен-
та.
В случае активации фермента самим субстратом, активность фермента
после достижения насыщающей концентрации субстрата не возрастает. Суб-
страт, как активатор, повышает стабильность фермента и облегчает формиро-
вание необходимой конформации активного центра фермента.
Для протеолитических ферментов характерен механизм активации путем
частичного протеолиза, т.е. отщепления части полипептидной цепи фермента в
результате неферментативного или ферментативного гидролиза. Такой способ
активации имеет очень важное физиологическое значение для пищеваритель-
ных ферментов, которые образуются из неактивных форм (проферменты)
именно благодаря механизму активации частичным протеолизом (см. главу 12
Раздела II).
Ингибирование ферментов. Ингибирование ферментов представляет
большой практический интерес для понимания механизмов ферментативного
катализа, строения активных центров ферментов и является инструментом изу-
чения роли отдельных химических реакций при расшифровке механизма дейст-
вия различных ингибиторов, например, лекарственных препаратов, ядохимика-
тов и др.
Следует различать смысл терминов «ингибитор» и «инактиватор». Об
«инактивации» правильнее говорить в случае торможения реакции под дейст-
вием агентов, денатурирующих фермент. Но следует отметить, что нередко ве-
щество в небольших концентрациях является ингибитором, а в больших – инак-
тиватором.
 2015-04-30
2015-04-30 2707
2707








