Проблемы структуры и функции ферментов, вопросы механизма их действия являются предметом изучения ведущих лабораторий мира. Повышение скорости реакции под действием ферментов объясняют тем, что при ферментативном катализе фермент соединяется (в принципе обратимо) со своим субстратом, образуя нестойкий промежуточный ферментсубстратный комплекс, который в конце реакции распадается с освобождением фермента и продуктов реакции (Арни, Михаэлис, Ментен, 1910-1915 гг.). Михаэлис не только постулировал образование промежуточного фермент-субстратного ES-комплекса, но и рассчитал влияние концентрации субстрата на скорость реакции.
В процессе реакции различают следующие стадии:
1. Присоединение молекулы субстрата к ферменту.
2. Преобразование первичного промежуточного соединения в один или несколько последовательных (переходных) комплексов.
3. Отделение конечных продуктов реакции от фермента.
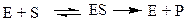
Пример:
E - фермент
S – субстрат
P - продукт
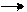 В реакциях анаболизма, допустим А+В AB, фермент может соединяться как с одним, так и с другим субстратом или обоими субстратами:
В реакциях анаболизма, допустим А+В AB, фермент может соединяться как с одним, так и с другим субстратом или обоими субстратами:
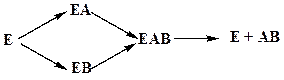
 В реакциях катаболизма, допустим: AB А+В
В реакциях катаболизма, допустим: AB А+В
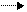 а) АВ+Е АВЕ
а) АВ+Е АВЕ
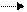
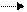 б) ABE А+ВЕ (а+б+в) АВ+Е А + В E
б) ABE А+ВЕ (а+б+в) АВ+Е А + В E
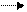 в) BE В+Е
в) BE В+Е
Схема образования промежуточного фермент-субстратного комплекса представлена на рисунке 4.2. Если фермент в активном центре содержит кофермент, то образуется тройной комплекс (рис.4.2.).
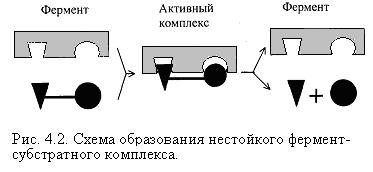
Фермент вступает во взаимодействие с субстратом на очень короткий период. Существование такого комплекса получило доказательство лишь в последние годы. В образовании фермент-субстратного комплекса участвуют водородные связи, электростатические и гидрофобные взаимодействия, а также, в ряде случаев, ковалентные, координационные связи. Информация о природе связей может быть получена методами электронного парамагнитного резонанса (ЭПР), ядерного магнитного резонанса (ЯМР), ультрафиолетовой и инфракрасной спектроскопии. Для каталитической активности существенное значение имеет пространственная структура ферментного белка, в которой жесткие участки α-спиралей чередуются с гибкими, эластичными линейными отрезками, обеспечивающими динамические изменения белковой молекулы фермента. В каталитическом процессе существенное значение имеют точное соответствие между ферментом и субстратом, а также термодинамические и каталитические преимущества подобного соответствия. Это означает, что между ферментом и субстратом должна быть не только пространственная или геометрическая комплементарность, но и электростатическая – спаривание противоположных зарядов (групп) субстрата и активного центра фермента.
Таким образом, в механизме ферментативного катализа ведущую роль играют промежуточные фермент-субстратные комплексы, образование которых определяется тонкой структурой активного и эффекторного центров и уникальной структурой всей молекулы фермента, обеспечивающими высокую каталитическую активность и специфичность действия биокатализаторов.
Кинетика ферментативных реакций зависит от природы реагирующих веществ – фермента, субстрата и условий их взаимодействия – концентрации, рН среды, температуры, присутствия активаторов или ингибиторов.
 2015-04-30
2015-04-30 477
477








