Биологическое окисление – это окислительно-восстановительные реакции, происходящие в клетках с участием ферментов, являющиеся источником энергии в организме. Химизм горения и биологического окисления, например, глюкозы происходят по общей схеме:
C6H12O6 +6O2 -> 6CO2 + 6 H2O+ 686 ккал (на 1 грамм-молекулу)
Но имеются отличия:
а) горение происходит при высокой температуре, а тканевое окисление – при 37 0C;
б) горение в воде невозможно, а тканевое окисление происходит в водной среде;
в) при горении энергия освобождается моментально в виде тепла, а при биологическом окислении энергия освобождается ступенчато, аккумулируется в молекулах АТФ.
Окисление в тканях может происходить:
а) присоединением кислорода;
б) потерей или отнятием от водорода электрона.
Под окислением понимают все химические реакции, в основе которых лежит отдача электронов и увеличение положительных валентностей. Если одно вещество окисляется, то другое – восстанавливается, т.е. присоединяет электроны.
Окислительно-восстановительные реакции – это перенос электронов, иногда и протонов.
Биологическое окисление – это совокупность окислительно-восстановительных реакций переноса электронов, происходящих в клетках.
Субстратное окисление – это отнятие электронов от промежуточных продуктов обмена углеводов, жиров и белков. Катализируется дегидрогеназами.
Тканевое дыхание – разновидность биологического окисления, при котором акцептором электрона является кислород.
Окисление в дыхательной цепи – это ферментативный перенос электронов от субстрата к кислороду по дыхательной цепи. Ферменты тканевого дыхания находятся в митохондриях, они строго упорядочены, обеспечивают передачу электронов и протонов от субстрата до кислорода, их называют метаболонами. Различают четыре группы ферментов: пиридинзависимые дегидрогеназы; флавиновые ферменты; убихинон (кофермент Q); цитохромная система.
1. Пиридинзависимые дегидрогеназы, к этой группе относится свыше 150 ферментов. Коферментами их являются никотинамидадениндинуклеотид (НАД+) и никотинамид-адениндинуклеотидфосфат (НАДФ+).
НАДФ+ отличается от НАД+ тем, что у второго углеродного атома рибозы атом водорода гидроксильной группы замещен остатком фосфорной кислоты.
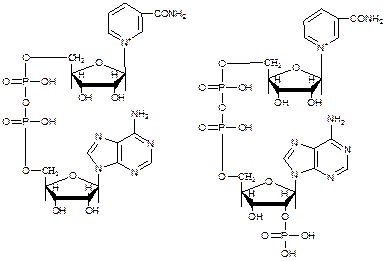
никотинамидадениндинуклеотид никотинамидадениндинуклео- (НАД+) тидфосфат (НАДФ+)
Восстановление НАД происходит путем переноса гидрид-иона (: Н-) от субстрата RH2 в положение 4 никотинамидного кольца:
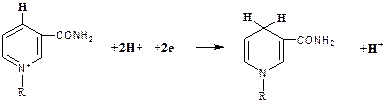
НАД+ НАДН
2. Флавиновые ферменты. Различают свыше 30 флавиновых ферментов. Коферментом их является флавинадениндинуклеотид (ФАД) и флавинмононуклеотид (ФМН).
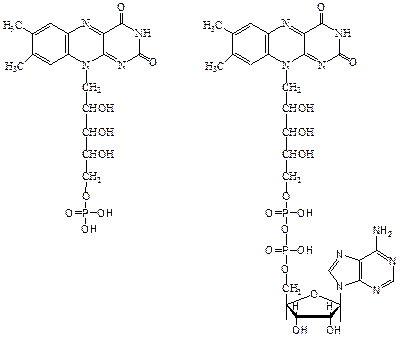
флавинмононуклеотид (ФМН) флавинадениндинук-
леотид (ФАД)
ФМН построен из молекулы витамина B2 и остатка фосфорной кислоты, а ФАД представляет собой ФМН, соединенный через фосфорную кислоту с АМФ. Восстановление ФАД (или ФМН) происходит путем переноса атомов водорода (и 2-х электронов) от субстрата RH2 в положение 1 и 10 молекулы рибофлавина:
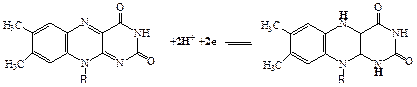
3. Убихинон (кофермент Q). Убихинон относится к очень широко распространенным коферментам. По химической природе представляет собой 2,3 - диметокси-5-метил-1,4-бензохинон с изопреновой цепью в 6-м положении. Число остатков изопрена в боковой цепи - 10. Восстановленная форма флавиновых ферментов (ФАДН2, ФМНН2) в цепи дыхательных катализаторов передает атомы водорода (протоны и электроны) KoQ. Как всякий хинон, KoQ может существовать как в окисленной, так и восстановленной форме (R-изопреноидная боковая цепь):
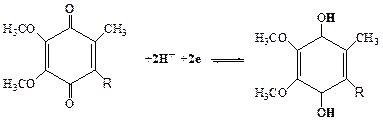
KoQ окисленный KoQ-H2 -восстановленный
4. Цитохромная система — цитохромоксидазы. Эти четыре группы ферментов осуществляют перенос протонов и электронов от окисляемых веществ на кислород (см. схему дыхательной цепи). Электроны, отщепленные от субстрата, передаются по дыхательной цепи до кислорода, где образуется молекула воды. В дыхательной цепи имеются механизмы, обеспечивающие синтез молекулы АТФ.
Биологическое окисление субстрата начинается с отнятия водорода - дегидрирования. Это происходит с участием НАД (или НАДФ). Дегидрогеназы, отщепив водород от окисляемого вещества, передают его флавиновым ферментам (ФАД, ФМН). Активной группой НАД является витамин В5 – амид никотиновой кислоты, принимая водород, он превращается в восстановленную форму (НАДН2). Далее происходит восстановление ФАД (ФМН), где активной группой является витамин B2. В дальнейшем атом водорода передается на убихинон, образуется восстановленная форма его KoQ.H2. Следующие ферменты дыхательной цепи – цитохромоксидазы. Эти хромопротеиды содержат железо, способное изменять свою валентность Fe2+ ↔ Fe 3+. В ходе каталитического процесса валентность железа изменяется обратимо. Различают цитохромы в, cl, с и аа3. Последовательность передачи электронов следующая:
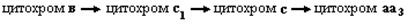
Цитохромы в - с1 - с являются промежуточными переносчиками, а цитохром ааЗ (цитохромоксидаза) – конечным ферментом, непосредственно взаимодействующим с кислородом. Окисленная форма Fe3+ принимает электроны от восстановленного цитохрома с, переходя в восстановленное Fe2+. Переносчиком электронов являются также белки, содержащие негеминовое железо. В этих белках несколько атомов железа связано с остатком цистеина. Указанные ферменты находятся в строгой последовательности в фиксированном состоянии на внутренней мембране митохондрий, их называют метаболонами (Рис. 7.2.).
 2015-04-30
2015-04-30 4362
4362
