Пример 1. Вычислите температуры кристаллизации и кипения водного раствора глюкозы С6Н12О6 с w(С6Н12О6)=0,02.
Решение. По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (Dt) по сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением 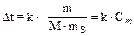 ,
,
где k–криоскопическая или эбуллиоскопическая константа. Для воды они соответственно равны 1,86 и 0,52°С×кг×моль–1, m и М соответственно масса растворенного вещества и его молярная масса; mS –масса растворителя, кг.
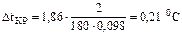 .
.
Вода кристаллизуется при 0 0С, следовательно, температура кристаллизации раствора
0 – 0,21= –0,21 °С.
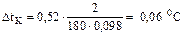 .
.
Вода кипит при 100 °С, следовательно, температура кипения этого раствора
100+0,06=100,06 °С.
Пример 2. Раствор, содержащий 11,04 г глицерина в 800г воды, кристаллизуется при –0,279 °С. Вычислите молярную массу глицерина.
Решение. 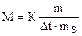 ;
; 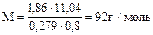 .
.
Пример 3. Вычислите массовую долю водного раствора мочевины (NH2)2CO, зная, что температура кристаллизации этого раствора –0,465 °С.
Решение.
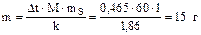 .
.
Общая масса раствора, содержащего 15 г мочевины, составляет 1000+15=1015 г.  W
W 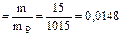 .
.
Пример 4. Вычислите температуру кипения раствора NаОН с массовой долей 0,2, если кажущаяся степень диссоциации NаОН в этом растворе равна 0,6.
Решение. NаОН относится к классу электролитов. Диссоциация электролита приводит к тому, что общее число частиц растворенного вещества (молекул и ионов) в растворе возрастает по сравнению с раствором неэлектролита той же концентрации. Изотонический коэффициент i учитывает это возрастание. Уравнения для вычисления свойств растворов электролитов запишутся следующим образом:
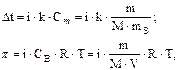
где p – осмотическое давление, кПа; V–объем раствора, л.
Изотонический коэффициент i связан со степенью диссоциации электролита a соотношением
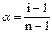 ,
,
где n число ионов, на которые распадается при диссоциации молекула электролита. NаОН диссоциирует на два иона
 NаОН Nа+ + ОН–.
NаОН Nа+ + ОН–.
Следовательно, n=2;
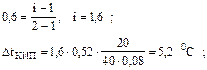
tКИП = tКИП(Н2О) +Dt = 100 + 5,2 = 105,2 °С.
Контрольные вопросы
176. Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,296 °С. Температура кристаллизации бензола 5,5 °С. Криоскопическая константа 5.1 °С ×кг×моль–1. Вычислите молярную массу растворенного вещества. Ответ: 128г/моль.
177. Вычислите массовую долю сахара С12Н22О11 в водном растворе, зная, что температура кристаллизации раствора –0,93 °С. Ответ: 0,146.
178. Вычислите температуру кристаллизации раствора мочевины (NН2)2СО, содержащего 5 г мочевины в 150г воды. Ответ: –1,03 °С.
179. Раствор, содержащий 3,04 г камфоры С10Н16О в 100г бензола, кипит при 80,714 °С. Температура кипения бензола 80,2 °С. Вычислите эбуллиоскопическую константу. Ответ: 2,57.
180. Вычислите массовую долю глицерина С3Н5(ОН)3 в водном растворе, зная, что этот раствор кипит при 100,39 °С. Ответ: 0,0645.
181. Вычислите молярную массу неэлектролита, зная, что раствор, содержащий 2,25 г этого вещества в 250г воды, кристаллизуется при –0,279 °С. Ответ: 60г/моль.
182. Вычислите температуру кипения раствора нафталина С10Н8 в бензоле с W(C10Н8)=0,05. Температура кипения бензола 80,2 0С. Эбуллиоскопическая константа его 2,570С ×кг×моль–1. Ответ: 81,25 0С.
183. Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при –0,465 °С. Вычислите молярную массу растворенного вещества. Ответ: 342г/моль.
184. Вычислите криоскопическую константу уксусной кислоты СН3СООН, зная, что раствор, содержащий 4,25 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,718 °С. Температура кристаллизации уксусной кислоты – 16,65 °С. Ответ: 3,9 °С∙кг∙моль–1.
185. При растворении 4,86 г серы в 60 г бензола температура кипения его повысилась на 0,81 °С. Сколько атомов содержит молекула серы в этом растворе? Эбуллиоскопическая константа бензола 2,57 °С ×кг×моль–1. Ответ: 8.
186. Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна –0,558 °С. Вычислите молярную массу растворенного вещества. Ответ: 442г/моль.
187. Какую массу анилина С6Н5NН2 следует растворить в 50 г эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53 °С. Эбуллиоскопическая константа этилового эфира 2,12 °С ×кг×моль–1. Ответ: 1,16 г.
188. Вычислите температуру кристаллизации водного раствора этилового спирта С2Н5ОН с W(С2Н5ОН)=0,02. Ответ: –0,82 0С.
189. Сколько граммов мочевины (NН2)2СО следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,465 °С? Ответ: 1,12г.
190. Вычислите массовую долю глюкозы С6Н12О6 в водном растворе, зная, что этот раствор кипит при 100,26 °С. Ответ: 0,0825.
191. Сколько граммов фенола С6Н5ОH следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7 °С? Криоскопическая константа бензола 5,1 °С ×кг×моль–1. Ответ: 3,91 г.
192. Сколько граммов мочевины (NН2)2СО следует растворить в 250 г воды, чтобы температура кипения повысилась на 0,26 °С? Ответ: 7,5 г.
193. При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0,372 °С. Вычислите молярную массу растворенного вещества. Ответ: 92 г/моль.
194. Вычислите температуру кипения водного раствора пропилового спирта С3Н7ОН с W(С3Н7ОН)=0,15. Ответ: 101,52 °С.
195. Вычислите массовую долю метанола СН3ОН в его водном растворе, температура кристаллизации которого –2,79 °С. Ответ: 0,0458.
196. Вычислите осмотическое давление при 273 К раствора, в 1 л которого содержится 8,7 г К2SО4. Кажущаяся степень диссоциации соли в воде равна 0,71. Ответ: 274,6 кПа.
197. Температура кристаллизации водного раствора КСl с W(КСl)=0,08 равна –3,7 °С. Вычислите степень диссоциации соли в растворе. Ответ: 0,7.
198. Вычислите степень диссоциации СаСl2 в растворе, содержащем 11,1 г СаСl2 в 500г воды. Температура кристаллизации такого раствора –0,74 °С. Ответ: 0,5.
199. Степень диссоциации соли в растворе, полученном из 8,0 г АgNO3 и 400г воды, составляет 0,6. Вычислите температуру кристаллизации раствора. Ответ: –0,188 °С.
200. Осмотическое давление раствора с 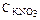 =0,01 моль/л при 27 °С составляет 0.45×105 Па. Вычислите степень диссоциации соли. Ответ: 0,8.
=0,01 моль/л при 27 °С составляет 0.45×105 Па. Вычислите степень диссоциации соли. Ответ: 0,8.
 2015-05-14
2015-05-14 7394
7394








