Пример 1. Найдите степень диссоциации слабой одноосновной кислоты НАn в растворе с СНАn=0,01моль/л, если константа диссоциации НАn равна 10–8.
Решение. Степень диссоциации найдем из закона разбавления Оствальда 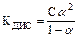 .
.
В случае очень слабых электролитов (a<< 1) (1–a)@1 и КДИС=Сa2.
Кислота НАn очень слабая, так как КДИС очень мала, поэтому
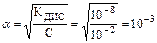 .
.
Таким образом, степень диссоциации НАn в растворе с СНАn=0,01 моль/л равна 0,1%.
Пример 2. Определите концентрацию ионов ОН– в растворе гидроксида аммония с 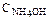 =0,01 моль/л, если КДИС=1,77×10–5.
=0,01 моль/л, если КДИС=1,77×10–5.
Решение. Для вычисления концентрации ионов данного вида С¢ИОН в растворе электролита пользуются зависимостью
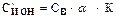 ,
,
где К – число ионов данного вида, получаемых при диссоциации одной молекулы электролита.
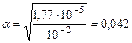 ;
;
СОН– = 10–2×0,042×1=0,42×10–3моль/л.
Пример 3. Произведение растворимости РbSO4 равно 2,2×10–8. Вычислите растворимость РbSO4 в моль/л и в г/л.
Решение. В насыщенном растворе малорастворимого электролита произведение концентраций его ионов в степенях их стехиометрических коэффициентов есть величина постоянная и называется произведением растворимости ПР.
 Для процесса Кn Аm(к) nКm+(р) + mAn–(р)
Для процесса Кn Аm(к) nКm+(р) + mAn–(р)
ПРКnАm=[Кm+]n ×[An–]m.
В общем виде выражение, связывающее растворимость Р(моль/л) и произведение растворимости ПР, записывается:
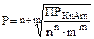 .
.
Согласно условию задачи 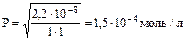
или 1,5×10–4×303= 4,54×10–2 г/л, где 303 г/моль –молярная масса РbSO4.
Пример 4. Растворимость Мg(ОН)2 равна 2×10–4 моль/л. Найдите произведение растворимости этого вещества.
Решение. Уравнение диссоциации МgОН)2
 Мg(ОН)2 Мg2+ +2ОН–
Мg(ОН)2 Мg2+ +2ОН–
Следовательно, [Mg2+]=2×10–4×1×1=2×10–4 моль/л;
[OH–]=2×10–4×1×2=4×10–4 моль/л.
Степень диссоциации принимается 1, т.к. электролит сильный.
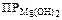 = [Mg2+]×[OH–]2 = 2×10–4(4×10–4)2 =3,2×10–11.
= [Mg2+]×[OH–]2 = 2×10–4(4×10–4)2 =3,2×10–11.
Пример 5. Вычислите рН 1%-ного раствора муравьиной кислоты НСООН, считая, что плотность раствора равна 1г/мл, а константа диссоциации муравьиной кислоты равна 1,76×10–4.
Решение. рН=–lg[H+].
В чистой воде и любом водном растворе произведение молярных концентраций водородных и гидроксид-ионов есть величина постоянная при постоянной температуре и называется ионным произведением воды Кw. При 25 °С Кw= 10–14. [H+]×[OH–]= Кw =10–14.
Исходя из условия 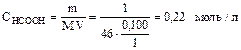 .
.
Тогда 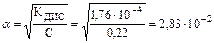 .
.
 НСООН Н+ + НСОО–;
НСООН Н+ + НСОО–;
[Н+] = CНСООН×a×К=0,22×2,83×10–2×1=6,2×10–3 моль/л;
рН=–lg6,2×10–3=3–lg6,2=3–0,79=2,21.
Контрольные вопросы
201. Какова концентрация ионов водорода в растворе НCN с СHCN=0,1 моль/л, если ее константа диссоциации К=7×10–10? Ответ: 8,36×10–6 моль/л.
202. В растворе СdCl2 (a=0,69) концентрация ионов хлора составляет 0,03 моль/л. Какова концентрация ионов кадмия? Вычислите в моль/л концентрацию недиссоциированной части СdCl2 и общую концентрацию электролита. Ответ: 0,01 моль/л, 0,006моль/л; 0,02 моль/л.
203. Во сколько раз концентрация ионов водорода в растворе НСl с СНСl= 0,1 моль/л (a=0,9) больше, чем в растворе с СНСl= 0,01 моль/л (a=0,98)? Ответ: в 9,2 раза.
204. Сравните концентрацию ионов водорода в растворе НNО3 с 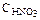 =0,01 моль/л (a=0,96) и в растворе Н2SO4 с СЭКВ(Н2SO4)=0,01моль/л (a=0,79). Ответ: в 1,2 раза.
=0,01 моль/л (a=0,96) и в растворе Н2SO4 с СЭКВ(Н2SO4)=0,01моль/л (a=0,79). Ответ: в 1,2 раза.
205. Вычислите концентрацию ионов водорода и степень диссоциации в 1%-ном растворе уксусной кислоты СН3СООН. Плотность раствора принять равной 1 г/мл; КДИС=1,8×10–5. Ответ: 0,17×10–2 моль/л; 1,03%.
206. Принимая во внимание константу первичной диссоциации угольной кислоты КI= 3×10–7, вычислите степень диссоциации и концентрацию ионов водорода в растворе этой кислоты с 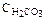 =0,1моль/л. Ответ: 0,0017; 1,7×10–4 моль/л.
=0,1моль/л. Ответ: 0,0017; 1,7×10–4 моль/л.
207. При какой концентрации (в моль/л) уксусной кислоты СН3СООН в растворе степень ее диссоциации составит 0.01?
К=1,8×10–5. Ответ: 0,18 моль/л.
208. Вычислите концентрацию ионов водорода (в моль/л), если концентрация ОН– ионов, выраженная в г/л, равна: а) 6,8×10–9,
б) 8,5×10–4. Ответ: а) 2,5×10–5; б) 2×10–10.
209. Вычислите рН раствора НСl с СНСl=0,001моль/л, приняв a=1. Ответ: 3,0.
210. Вычислите рН 0,036%-ного раствора НСl. Плотность раствора и степень диссоциации НСl считать равными единице. Ответ: 2,0.
211. Вычислите рН 0,004%-ного раствора NаОН. Плотность раствора и степень диссоциации NаОН считать равными единице. Ответ: 11,0.
212. Вычислите рН 0,3%-ного раствора уксусной кислоты СН3СООН. КДИС=1,8×10–5. Плотность раствора принять равной единице. Ответ: 3,02.
213. Сколько граммов КОН находится в 1 л раствора, рН которого равен 11? Степень диссоциации КОН принять равной единице. Ответ: 0,056 г.
214. Чему равна концентрация ионов Н+ в водном растворе муравьиной кислоты НСООН, если a=0,03, а КДИС=1,8×10–4? Ответ: 0,006 моль/л.
215. Сколько граммов гидроксида натрия растворено в 200 мл раствора NaOH, если рН этого раствора 12? Ответ: 0,08 г.
216. Вычислите рН раствора Н2SО4 (a=1) с СЭК(Н2S4)=
=1×10–2 моль/л. Ответ: 2,0.
217. Вычислите степень диссоциации растворов NH4ОН ( 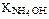 =1,8×10–5) с
=1,8×10–5) с 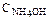 = 0,05 моль/л и
= 0,05 моль/л и 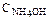 = 0,5 моль/л. Как влияет концентрация растворенного вещества на степень диссоциации? Ответ: 1,9×10–2 и 6,0×10–3.
= 0,5 моль/л. Как влияет концентрация растворенного вещества на степень диссоциации? Ответ: 1,9×10–2 и 6,0×10–3.
218. Рассчитайте рН раствора Н3РО4 с 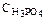 = 0,01 моль/л,
= 0,01 моль/л,
К1 = 7,5×10–3. (Диссоциацией по второй и третьей ступеням пренебречь.) Ответ: 2,06.
219. Рассчитайте рН раствора Н2СО3 с 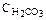 = 0,01 моль/л. (Диссоциацией по второй ступени пренебречь.) К1 = 4,4×10–7. Ответ: 4,18.
= 0,01 моль/л. (Диссоциацией по второй ступени пренебречь.) К1 = 4,4×10–7. Ответ: 4,18.
220. Вычислите константу диссоциации NH4OH, если степень диссоциации раствора NН4ОН с 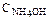 =0,002 моль/л равна 10 %. Ответ: 2×10–5.
=0,002 моль/л равна 10 %. Ответ: 2×10–5.
221. Произведение растворимости СаSO4 составляет 2,4×10–5. Вычислите растворимость СаSO4 в моль/л и в г/л. Ответ: 4,9×10–3 моль/л; 0,67 г/л.
222. Насыщенный раствор BaCrO4 содержит 1,5×10–5 моль соли в 1 л раствора. Вычислите произведение растворимости BaCrO4. Ответ: 2,25×10–10.
223. В 1 л насыщенного при комнатной температуре раствора AgIO3 содержится 0,044 г соли. Вычислите произведение растворимости AgIO3. Ответ: 2,4×10–8.
224. Произведение растворимости АgI составляет 1,5×10–16. Вычислите растворимость АgI в моль/л и в г/л. Ответ: 1,22×10–8 моль/л; 2,87×10–6.
225. Произведение растворимости SrSO4 составляет 2,8×10–7.. Вычислите, в каком объеме содержится 0,1 г SrSO4. Ответ: 1,03 л.
 2015-05-14
2015-05-14 13006
13006
