Пример 1. Написать выражения закона действия масс для реакций:
а) 2NO(Г)+О2(Г)=2NO2(Г);
б) FеO(К)+CO(Г)=Fe(К)+CO2(Г).
Решение. а) V =k×C2NO × 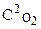 (реакция гомогенная);
(реакция гомогенная);
б) поскольку оксид железа (II) находится в твердом состоянии, его концентрация в ходе реакции не меняется и выражение для скорости данной гетерогенной реакции будет следующим: V = k× CCO.
Пример 2. Как изменяется скорость реакции образования аммиака N2(Г)+3H2(Г)=2NH3(Г) при уменьшении объема реакционного сосуда в 5 раз?
Решение. До изменения объема системы скорость реакции выражалась уравнением V = k× 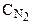 ×
× 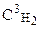 . При уменьшении объема системы концентрация каждого компонента возрастает в 5 раз:
. При уменьшении объема системы концентрация каждого компонента возрастает в 5 раз:
V'= k×5 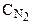 ×(5
×(5 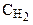 )3 =625×k×
)3 =625×k× 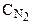 ×
× 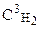 .
.
Сравнивая выражения для V и V', находим, что скорость реакции возрастёт в 625 раз.
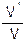
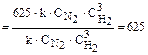 .
.
Пример 3. Температурный коэффициент реакции равен 3. Найдите, во сколько раз увеличится скорость этой реакции при увеличении температуры на 30 градусов.
Решение. По правилу Вант-Гоффа 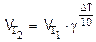 ;
;
DТ=30 К, g=3;
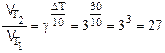 .
.
Таким образом, при повышении температуры на 30 градусов скорость ее возросла в 27 раз.
Пример 4. В момент установления равновесия в системе
 N2(Г)+3H2(Г) 2NH3(Г)
N2(Г)+3H2(Г) 2NH3(Г)
равновесные концентрации азота, водорода и аммиака соответственно равны 2,5; 1,8 и 3,6 моль/л. Вычислите константу химического равновесия этой реакции (КС) и начальные концентрации азота и водорода (С0).
Решение. Вычислим константу равновесия
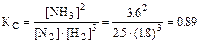 .
.
Из уравнения реакции следует, что на образование 2 моль NH3 расходуется 1 моль N2. Следовательно, на образование 3,6 моль NH3 необходимо 3,6:2=1,8 моль N2 (убыль N2 в ходе реакции). Отсюда
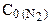 =[N2]+ D
=[N2]+ D 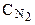 = 2,5+1,8=4,3 (моль/л).
= 2,5+1,8=4,3 (моль/л).
Аналогично рассматриваем начальную концентрацию H2: на образование 2 моль NH3 расходуется 3 моль Н2, а для получения 3,6 моль NH3 требуется 3,6×3/2=5,4 моль Н2 (убыль Н2 в реакции).
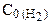 =[H2]+ D
=[H2]+ D 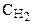 = 1,8+ 5,4=7,2 (моль/л).
= 1,8+ 5,4=7,2 (моль/л).
Таким образом, реакция начиналась при исходных концентрациях азота и водорода: 4,3 моль/л и 7,2 моль/л соответственно.
Пример 5. Как повлияет повышение концентраций исходных веществ и понижение температуры и давления на равновесие реакции

 , DН°=–41,2 кДж?
, DН°=–41,2 кДж?
Решение. Согласно принципу Ле-Шателье, увеличение концентрации СО и Н2О приведет к смещению равновесия в сторону реакции, уменьшающей концентрации этих веществ, т.е. равновесие смещается вправо, в сторону прямой реакции. Из термохимического уравнения реакции видно, что прямая реакция является экзотермической (DН<0) и понижение температуры реакции сместит равновесие в сторону нагрева системы, т.е. в сторону экзотермической реакции, вправо.
Из уравнения реакции видно, что реакция проходит в газовой фазе без изменения числа частиц газообразных веществ (вступают в реакцию 2 частицы и образуются 2 частицы). Поэтому понижение давления не приведет к смещению химического равновесия данной реакции.
Контрольные вопросы
126. Во сколько раз изменится скорость реакции 2А+В=А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза? Ответ: возрастет в 2 раза.
127. В начальный момент протекания реакции N2+3H2=2NH3 концентрации были равны: 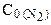 =1,5 моль/л;
=1,5 моль/л; 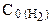 =2.5 моль/л. Какими будут концентрации азота и водорода тогда, когда концентрация аммиака будет равна 0,5 моль/л? Ответ: 1.25 моль/л и 1.75 моль/л.
=2.5 моль/л. Какими будут концентрации азота и водорода тогда, когда концентрация аммиака будет равна 0,5 моль/л? Ответ: 1.25 моль/л и 1.75 моль/л.
128. Начальные концентрации веществ в реакции
 СО+H2O(Г) СО2+Н2
СО+H2O(Г) СО2+Н2
были равны: С0(СО)=0,5моль/л; 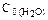 =0,6моль/л;
=0,6моль/л; 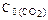 =0,4 моль/л;
=0,4 моль/л; 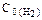 =0,2 моль/л. Вычислить концентрации всех веществ после того, как прореагировало 60 % Н2О. Ответ: 0,24 моль/л; 0,14 моль/л; 0,76 моль/л; 0,56 моль/л.
=0,2 моль/л. Вычислить концентрации всех веществ после того, как прореагировало 60 % Н2О. Ответ: 0,24 моль/л; 0,14 моль/л; 0,76 моль/л; 0,56 моль/л.
129. Через некоторое время после начала реакции
 3А+В 2С+D
3А+В 2С+D
концентрации веществ составили: СА=3 моль/л; СВ=1моль/л, СС=0,8 моль/л. Каковы начальные концентрации веществ А и В? Ответ: 4,2 моль/л и 1,4моль/л.
130.  В системе СО+Cl2 COCl2
В системе СО+Cl2 COCl2
концентрацию СО увеличили от 0,3 до 1,2 моль/л, а концентрацию Сl2 – от 0,2 до 0,6 моль/л. Во сколько раз возросла скорость прямой реакции? Ответ: в 12 раз.
131.  Константа скорости реакции А+2В 3С
Константа скорости реакции А+2В 3С
равна 0,6 л2/(моль2×с). Начальные концентрации: С0(А)=2,0 моль/л; С0(В)=2,5 моль/л. В результате реакции концентрация вещества В оказалась равна 0,5 моль/л. Найдите концентрацию вещества А и скорость реакции. Ответ: 1,0 моль/л; 0,15 моль/(л×с).
132. Во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 °C до 80 °C. Температурный коэффициент скорости реакции равен 3. Ответ: в 81 раз.
133. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возросла в 15,625 раза? Ответ: 2,5.
134. При 150 °C реакция заканчивается за 16 мин. Принимая температурный коэффициент скорости реакции равным 2,5, рассчитайте, через какое время закончится эта реакция, если проводить ее при: а) 200 °C; б) 80 °C. Ответ: а) 9,8 с; б) 162,76 ч.
135.  В гомогенной системе CO+Cl2 COCl2 равновесные концентрации веществ равны: [CO]=0,2 моль/л, [Cl2]=0,3 моль/л, [COCl2]=1,2моль/л. Вычислите константу равновесия и начальные концентрации Cl2 и СО. Ответ: 20; 1,5 моль/л; 1,4 моль/л.
В гомогенной системе CO+Cl2 COCl2 равновесные концентрации веществ равны: [CO]=0,2 моль/л, [Cl2]=0,3 моль/л, [COCl2]=1,2моль/л. Вычислите константу равновесия и начальные концентрации Cl2 и СО. Ответ: 20; 1,5 моль/л; 1,4 моль/л.
 136. Через некоторое время после начала реакции
136. Через некоторое время после начала реакции
4HCl+O2 2Н2О+2Сl2 концентрации ее участников стали равны: СHCl=0,85 моль/л; 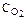 =0,44 моль/л;
=0,44 моль/л; 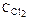 =0,30 моль/л. Какими были концентрации HCl и О2 в начальный момент времени? Ответ: 1,45моль/л; 0,59моль/л.
=0,30 моль/л. Какими были концентрации HCl и О2 в начальный момент времени? Ответ: 1,45моль/л; 0,59моль/л.
137. Вычислите, при какой температуре реакция закончится за 45 мин, если при 293 К на это требуется 3 часа. Температурный коэффициент скорости реакции равен 3,2. Ответ: 304,9 К.
138. При некоторой температуре равновесие в системе
 2NO2 2NO + O2
2NO2 2NO + O2
установилось при следующих концентрациях: [NO2]=0,06 моль/л, [NO]=0,24 моль/л, [O2]=0,12 моль/л. Найти константу равновесия этой реакции и начальную концентрацию NO2. Ответ: 1,92; 0,3 моль/л.
139. При 713 К константа диссоциации HI равна 1/64. Найти концентрации Н2, I2 и НI в состоянии равновесия, если вначале было взято 2 моль НI. Объем реакционного сосуда равен 5 л. Ответ: 0,04 моль/л; 0,04 моль/л; 0,032 моль/л.
140.  В гомогенной системе А+2В С равновесные концентрации равны: [А] = 0,06 моль/л; [В] = 0,12 моль/л; [С] = 0,216 моль/л. Вычислите константу равновесия и начальные концентрации веществ А и В. Ответ: 250; 0,276 моль/л; 0,552 моль/л.
В гомогенной системе А+2В С равновесные концентрации равны: [А] = 0,06 моль/л; [В] = 0,12 моль/л; [С] = 0,216 моль/л. Вычислите константу равновесия и начальные концентрации веществ А и В. Ответ: 250; 0,276 моль/л; 0,552 моль/л.
141. Константа равновесия реакции
 FeO(К)+CO(Г) Fe(К)+CO2(Г)
FeO(К)+CO(Г) Fe(К)+CO2(Г)
при некоторой температуре равна 0,5. Найдите равновесные концентрации CO и CO2, если их начальные концентрации были равны: C0(CO) = 0,05 моль/л; 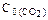 = 0,01 моль/л. Ответ: 0,04 моль/л; 0,02 моль/л.
= 0,01 моль/л. Ответ: 0,04 моль/л; 0,02 моль/л.
142.  Константа равновесия реакции A(Г)+B(Г) C(Г)+D(Г) равна единице. Сколько процентов вещества A подвергается превращению, если смешать 3 моль вещества A и 5 моль вещества B?
Константа равновесия реакции A(Г)+B(Г) C(Г)+D(Г) равна единице. Сколько процентов вещества A подвергается превращению, если смешать 3 моль вещества A и 5 моль вещества B?
Ответ: 62,5 %.
143. Реакция протекает по уравнению 2A B. Начальная концентрация вещества A равна 0,2 моль/л. Константа равновесия реакции
KC=0,5. Определите равновесные концентрации веществ A и B.
Ответ: 0,170 моль/л; 0,015 моль/л.
144. Почему при изменении давления смещается равновесие системы
 N2+3H2 2NH3
N2+3H2 2NH3
и не смещается равновесие системы
 N2+O2 2NO?
N2+O2 2NO?
Ответ мотивируйте на основании расчета скоростей прямой и обратной реакций в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из систем.

 145. В каком направлении сместится равновесие реакции 2CO+2H2 CH4+CO2, если концентрации всех реагирующих веществ уменьшить в 3 раза?
145. В каком направлении сместится равновесие реакции 2CO+2H2 CH4+CO2, если концентрации всех реагирующих веществ уменьшить в 3 раза?
146. Как повлияет на равновесие реакций
 2H2(Г)+O2(Г) 2H2O(Г), DH° = – 483,6кДж,
2H2(Г)+O2(Г) 2H2O(Г), DH° = – 483,6кДж,
 CaCO3(К) CaO(К)+CO2(Г), DH° = 179кДж
CaCO3(К) CaO(К)+CO2(Г), DH° = 179кДж
а) повышение давления; б) повышение температуры?
Ответы мотивируйте.
147. Указать, какими изменениями концентраций реагирующих веществ можно сместить вправо равновесие реакции
 CO2(Г)+C(графит) 2CO (Г).
CO2(Г)+C(графит) 2CO (Г).
148. При состоянии равновесия в гомогенной системе
 N2+3H2 2NH3
N2+3H2 2NH3
концентрации веществ были равны: [N2] = 0,3 моль/л; [H2] = 0,9 моль/л; [NH3] = 0,4 моль/л. Рассчитайте, как изменятся скорости прямой и обратной реакции, если увеличить давление в системе в 5 раз. В каком направлении сместится равновесие? Ответ: увеличатся в 625 раз и в 25 раз; вправо.
149. В каком направлении будет смещаться равновесие при повышении температуры и давления для следующих обратимых реакций:
 а) 2SO2(Г)+O2(Г) 2SO3(Г), DH° = – 196,6кДж;
а) 2SO2(Г)+O2(Г) 2SO3(Г), DH° = – 196,6кДж;
 б) 3O2(Г) 2O3(Г), DH° = 184,6кДж;
б) 3O2(Г) 2O3(Г), DH° = 184,6кДж;
 в) 2CO(Г) + O2(Г) 2CO2(Г), DH° = – 566,0кДж.
в) 2CO(Г) + O2(Г) 2CO2(Г), DH° = – 566,0кДж.
150. Химическое равновесие гомогенной реакции
 COCl2 CO+Cl2
COCl2 CO+Cl2
установилось при концентрациях участвующих в реакции веществ: [COCl2] = 10 моль/л; [CO] = 2 моль/л; [Cl2] = 4 моль/л. В равновесную систему добавили хлор в количестве 4 моль/л. Определите новые равновесные концентрации реагирующих веществ после смещения равновесия. Ответ: 10,8 моль/л; 1,2 моль/л; 7,2 моль/л.
 2015-05-14
2015-05-14 23714
23714
