Пример 1. Гальванический элемент состоит из металлического цинка, погруженного в 0,1 М раствор нитрата цинка, и металлического свинца, погруженного в 0,02 М раствор нитрата свинца.. Вычислите ЭДС элемента при 25 °С, напишите уравнения электродных процессов, составьте схему элемента.
Решение. Чтобы вычислить ЭДС элемента, необходимо вначале вычислить электродные потенциалы по уравнению Нернста:
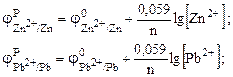
Из табл. П6 находим значение j°, а затем подставляем в уравнения и рассчитываем.
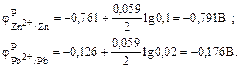
Поскольку 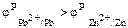 ,то на свинцовом электроде будет протекать процесс восстановления:
,то на свинцовом электроде будет протекать процесс восстановления:
Pb2+ + 2e = Pb.
На цинковом электроде будет протекать процесс окисления:
Zn=Zn2+ + 2e.
Схема рассматриваемого гальванического элемента имеет следующий вид: Zn/Zn(NO3)2
(0,1M)//Pb(NO3)2(0,02M)/Pb.
Находим ЭДС элемента:
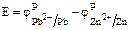 = –0,176– (–0,791)= 0,615 В.
= –0,176– (–0,791)= 0,615 В.
Пример 2. Вычислите активность ионов Н+ в растворе, в котором потенциал водородного электрода при 25 °С равен –82 мВ.
Решение. Поскольку j° для водородного электрода принят за ноль, то уравнение Нернста для водородного электрода будет иметь вид
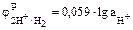 .
.
Из данного уравнения находим
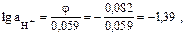
откуда 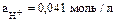 .
.
Контрольные вопросы
276. Вычислите электродный потенциал системы Cu/0,2н. CuSO4 при 25 °С, если степень диссоциации сульфата меди равна 40 %.
Ответ: 0,300 В.
277. Гальванический элемент состоит из металлического серебра, погруженного в 0,1н. раствор нитрата серебра, и металлического кадмия, погруженного в 0,02н. раствор сульфата кадмия. Составьте схему элемента, напишите уравнение электродных реакций и вычислите ЭДС элемента при 25 °С. Ответ: 1,201 В.
278. Потенциал электрода Рt, H2/ [NaOH] = x моль/л. при 25 °С равен -767 мВ. Каковы молярная концентрация раствора едкого натра и его титр? Ответ: 0,1 моль/л; 0,004 г/см3 .
279. Гальванический элемент состоит из металлического алюминия, погруженного в 0,006 н. раствор сульфата алюминия, и металлической меди, погруженной в 0,04 н. раствор нитрата меди. Составьте схему элемента, напишите уравнение электродных реакций и вычислите ЭДС элемента при 25 °С. Ответ: 2,008 В.
280. Укажите схему свинцового аккумулятора и напишите электродные реакции, которые протекают на электродах при его зарядке и разрядке.
281. Гальванический элемент состоит из металлического железа, погруженного в 0,02 н. раствор сульфата железа (II), и металлического золота, погруженного в 0,01н. раствор хлорида золота (I). Составьте схему элемента, напишите уравнения электродных реакций и вычислите ЭДС элемента при 25 °С. Ответ: 2,062 В.
282. Потенциал электрода Pt, H2 / раствор HCl неизвестной концентрации при 25 °С равен –118 мВ. Определите молярную концентрацию раствора соляной кислоты и вычислите его титр. Ответ: 0,01 моль/л; 0,000365 г/см3.
283. Гальванический элемент состоит из металлического свинца, погруженного в 0,02 н. раствор нитрата свинца, и металлического магния, погруженного в 0,002 н. раствор сульфата магния. Составьте схему элемента, напишите уравнения электродных реакций и вычислите ЭДС элемента при 25 °С. Ответ: 2,267 В.
284. Гальваническая цепь составлена из нормального водородного электрода и свинцового электрода, погруженного в насыщенный раствор сульфата свинца. 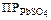 = 2×10–8. Найти величину электродного потенциала Pb2+/Pb. Запишите схему элемента и вычислите его ЭДС при 25 °С. Ответ: –0,240 В; 0,240 В.
= 2×10–8. Найти величину электродного потенциала Pb2+/Pb. Запишите схему элемента и вычислите его ЭДС при 25 °С. Ответ: –0,240 В; 0,240 В.
285. Гальванический элемент состоит из металлической меди, погруженной в 0,2н. раствор сульфата меди, и металлического цинка, погруженного в 0,02н. раствор хлорида цинка. Вычислите ЭДС элемента при 25 °С, напишите уравнения электродных реакций, составьте схему элемента. Ответ: 1,128 В.
286. ЭДС цепи Cu/[CuSO4] = x//0,1 н. ZnSO4/Zn при 25 °С равна 1,039 В. Определите концентрацию ионов меди. Ответ: 5×10–4 моль/л.
287. Составьте схему гальванического элемента, при работе которого протекает реакция Ni + Pb(NO3)2= Ni(NO3)2 + Pb.
Напишите электродные уравнения процессов, протекающих на электродах, и вычислите ЭДС элемента при 25 °С и концентрации Pb(NO3)2 и Ni(NO3)2 соответственно 0,2н. и 0,01М. Ответ: 0,139 В.
288. Гальванический элемент состоит из металлического серебра, погруженного в 0,0001 н. раствор нитрата серебра, и металлического свинца, погруженного в 0,002 н. раствор нитрата свинца. Составьте схему элемента, напишите уравнение электродных реакций, вычислите ЭДС элемента при 25 °С. Ответ: 0,778 В.
289. Гальванический элемент состоит из металлического цинка, погруженного в 0,02н. раствор хлорида цинка, и металлической меди, погруженной в 0,1М. раствор хлорида меди. Составьте схему элемента, напишите уравнение электродных реакций, вычислите ЭДС элемента при 25 °С. Ответ: 1,128 В.
290. Укажите схему кадмий-никелевого аккумулятора и напишите электронные процессы, которые протекают на электродах при зарядке и разрядке данного аккумулятора.
291. Гальванический элемент состоит из металлического кадмия, погруженного в 0,002н. раствор нитрата кадмия, и металлического серебра, погруженного в 0,01 н. раствор нитрата серебра. Составьте схему элемента, напишите уравнения электродных реакций, вычислите ЭДС элемента при 25 °С. Ответ: 1,172 В.
292. Вычислите потенциал кислородного электрода в кислой среде при pH, равной 2, и температуре, равной 25 °С. Ответ: 1,109 В.
293. Электродный потенциал системы Zn/0,2 н. ZnSO4 при 25 °С найден, равным -0,8013 В. Чему равна степень диссоциации ZnSO4 в указанном растворе? Ответ: 0,44.
294. Вычислите потенциал свинцового электрода при 25 0С, в насыщенном растворе PbBr2, если [Br–] = 1 моль/л., а 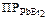 = 9,1×10–6. Ответ: –0,275 В.
= 9,1×10–6. Ответ: –0,275 В.
295. Гальванический элемент состоит из металлического цинка, погруженного в 0,02 н. раствор сульфата цинка, и металлического никеля, погруженного в 0,002 н. сульфата никеля. Составьте схему элемента, напишите уравнения электродных реакций и вычислите ЭДС элемента при 25 °С. Ответ: 0,496 В.
296. Гальванический элемент состоит из металлического свинца, погруженного в 0,02 н. раствор азотнокислого свинца, и металлического никеля, погруженного в 0,001 М раствор сульфата никеля. Составьте схему элемента, напишите уравнение электродных реакций и вычислите ЭДС элемента при 25 °С. Ответ: 0,140 В.
297. Схема элемента Pt,H2/0,01 н. HNO2//1 н. CH3COOH/H2,Pt. Определите ЭДС элемента ( 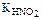 = 4×10–4,
= 4×10–4, 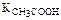 = 1,76×10–5) при 25 °С. Ответ: 0,019 В.
= 1,76×10–5) при 25 °С. Ответ: 0,019 В.
298. Укажите схему цинк-серебряного аккумулятора и напишите электронные процессы, которые протекают на электродах при его зарядке и разрядке.
299. Вычислите потенциал кислородного электрода в щелочной среде при pH = 13, и температуре, равной 25 °С. Ответ: 0,460 В.
300. ЭДС гальванического элемента
Pt,H2/1 н. CH3COOH//0,5 н. HCOOH/H2,Pt при 25 °С равна 20,65 мВ. 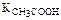 = 1,76×10–5. Определите КHCOOH. Ответ: 1,76×10–4.
= 1,76×10–5. Определите КHCOOH. Ответ: 1,76×10–4.
 2015-05-14
2015-05-14 10419
10419








