Пример. Какие вещества и в каком количестве выделились на электродах, если через раствор сульфата никеля пропускали ток силой 5 А в течение 1 часа. Оба электрода выполнены: а) из никеля, б) из инертного материала.
Решение. При электролизе раствора сульфата никеля в случае никелевых электродов на катоде возможно протекание двух процессов:
- восстановление ионов никеля
Ni2+ + 2e= Ni;
- восстановление молекул воды
2H2O + 2e= H2 + 2OH–.
Стандартный потенциал первого процесса 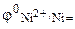 –0,236 В, второго –0,414 В (раствор сульфата никеля имеет слегка подкисленную среду). Поскольку
–0,236 В, второго –0,414 В (раствор сульфата никеля имеет слегка подкисленную среду). Поскольку 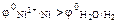 , то на катоде будет протекать первый процесс, т.е. восстановление ионов никеля.
, то на катоде будет протекать первый процесс, т.е. восстановление ионов никеля.
На аноде возможно протекание трех процессов:
- окисление материала анода
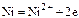 ;
;
- окисление молекул воды
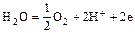 ;
;
- окисление ионов сульфата
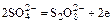 .
.
Стандартные электродные потенциалы данных процессов соответственно равны:
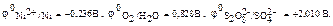
Наименьшим электродным потенциалом обладает первый процесс, следовательно, на аноде будет протекать процесс окисления никеля.
В случае инертных электродов на катоде характер протекания электродного процесса не изменится и будут восстанавливаться ионы никеля. На аноде окисление материала анода происходить не будет и возможно протекание двух процессов:
- окисление молекул воды
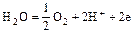 ;
;
- окисление ионов сульфата
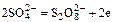 ;
;
т.к. 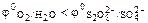 , то на аноде выделяется кислород.
, то на аноде выделяется кислород.
Количество выделившегося никеля на катоде можно оценить из закона Фарадея
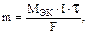
где m – масса выделившегося никеля на катоде, г; I – сила тока, А; t– продолжительность электролиза, с; F – постоянная Фарадея, Кл; MЭК – молярная масса эквивалентов никеля, г/моль;
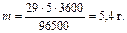
Объем выделившегося кислорода на аноде при нормальных условиях целесообразно рассчитать из второго закона Фарадея
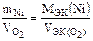 ,
,
где mNi – масса выделившегося никеля на катоде; 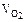 – объем выделившегося кислорода на аноде; МЭК(Ni) – молярная масса эквивалентов никеля;
– объем выделившегося кислорода на аноде; МЭК(Ni) – молярная масса эквивалентов никеля;  – объем эквивалентов кислорода.
– объем эквивалентов кислорода.
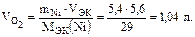
Контрольные вопросы
301. Через раствор серной кислоты пропускали ток силой 2 А в течение 2 часов. Сколько литров водорода, измеренного при нормальных условиях, выделилось на катоде? Составьте электронные уравнения процессов, происходящих на инертных электродах. Ответ: 1,67л.
302. Сколько времени пропускали через раствор щелочи ток силой 3 А, если при этом выделилось 2,24 л кислорода, измеренного при нормальных условиях? Составьте электронные уравнения процессов, происходящих на электродах, считая, что они выполнены из инертного материала. Ответ: 3,57 ч.
303. Через раствор сульфата цинка пропускали ток силой 2 А в течение 1 часа. Сколько граммов цинка выделилось на катоде? Составьте электронные уравнения процессов, происходящих на электродах, если они выполнены из инертного материала. Ответ: 2,43 г.
304. Сколько времени пропускали ток силой 10 А через раствор щелочи, если при этом было получено 8,4 л водорода, измеренного при нормальных условиях. Составьте электронные уравнения процессов, происходящих на электродах, если они выполнены из инертного материала. Ответ: 2 ч.
305. Составьте электронные уравнения процессов, происходящих на инертных электродах при электролизе раствора MgCl2. Какие вещества и в каких количествах выделятся из раствора, если пропустить через него ток силой 5 А в течение 32 мин 10 с.? Ответ: 1,12 л.
306. Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов NiSO4; NiCl2. В обоих случаях анод угольный. Сколько вещества выделится на катоде, если пропустить через эти растворы ток 5 А в течение 1 часа? Ответ: 5,47г.
307. При электролизе раствора CuSO4 на аноде выделилось 420 мл газа, измеренного при нормальных условиях. Составьте электронные уравнения происходящих процессов на электродах при электролизе CuSO4, если анод – угольный, а катод – медный. Вычислите количество вещества, выделившегося на катоде. Ответ: 2,4 г.
308. Составьте электронные уравнения процессов, происходящих на инертных электродах при электролизе K2SO4 и вычислите количество электролита, которое разложилось при пропускании через раствор тока силой 4 А в течение 3ч. Ответ: 4,03 г.
309. Какие вещества и в каком количестве выделились на электродах, если через раствор нитрата серебра пропускали ток силой 2 А в течение 4 ч? Оба электрода выполнены из серебра.
Ответ: 32,2 г; 1,67 л.
310. Через раствор сульфата некоторого металла пропускали ток силой 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите молярную массу эквивалентов металла.
Ответ: 32,7 г/моль.
311. Какие вещества и в каком количестве выделятся в результате процессов, происходящих на электродах, раствора NaOH, расплава NaOH, если через систему пропускали ток силой 5 А в течение 30 мин? Ответ: 2,15 г; 1,04 л; 0,52 л.
312. Через раствор сульфата натрия пропускали ток в течение 2 часов, в результате чего выделилось 2 л кислорода, измеренного при нормальных условиях. Вычислите силу тока. Ответ: 4,78 А.
313. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора CuSO4, в случае угольного анода; в случае медного анода.
314. Сколько времени пропускали ток силой 2 А через раствор хлорида натрия, если при этом образовалось 80 г едкого натра? Ответ: 26,8 час.
315. Через раствор хлорида натрия пропускали ток силой 15 А в течение 16 мин 5 с. Какой газ и в каком объеме, измеренном при нормальных условиях, выделится на катоде? Сколько граммов гидроксида натрия образовалось у катода? Ответ: 1,68 л; 6 г.
316. Через растворы NiSO4 и Pb(NO3)2 пропускали одно и то же количество электричества. На одном из катодов выделилось 25,9 г свинца. Сколько граммов никеля выделилось на другом катоде? Какой газ и в каком объеме, измеренном при нормальных условиях, выделился на каждом из анодов? Ответ: 7,34 г; 1,4 л.
317. Ток силой 10 А пропускали в течение 20 мин через раствор сульфата меди при медном аноде. На сколько граммов уменьшится масса анода? Составьте электронные уравнения процессов, происходящих на электродах. Ответ: 3,98 г.
318. Какие процессы происходят на электродах при электролизе раствора AgNO3, если анод серебряный; если анод угольный. Составьте электронные уравнения.
319. Сколько времени пропускали ток силой 8 А через раствор сульфата никеля, если масса никелевого анода стала меньше на 0,8805 г? Ответ: 361,2 с.
320. Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов CdCl2; CdSO4. В обоих случаях анод угольный.
321. При электролизе Cr2(SO4)3 током 1 А масса катода возросла на 10 г. Какое количество электричества и в течение какого времени пропущено? Ответ: 55673 Кл.
322. Какие вещества и в каком количестве выделяются при прохождении 48250 Кл через водный раствор MgCl2. Составьте электронные уравнения происходящих на электродах процессов, если оба электрода угольные. Ответ: 5,6 л.
323. Сколько электричества надо пропустить через раствор NaCl, чтобы получить 1 кг NaOH. Составьте электронные уравнения процессов, происходящих на электродах, если катод – железный, а анод – угольный. Ответ: 2,4×106 Кл.
324. Вычислите молярную массу эквивалентов железа, если при прохождении через раствор соли железа тока 5 А в течение 5,36 часа выделилось 27,9 г Fe. Ответ: 27,9 г/моль.
325. Какие вещества и в каком количестве образуются при пропускании тока 6 А в течение 1 часа через раствор KOH. Составьте электронные уравнения процессов, происходящих на электродах, если оба электрода угольные. Ответ: 2,5 л; 1,25 л.
 2015-05-14
2015-05-14 11641
11641








