00000000000000000000000000000
0,01 М HNO3 ерiтiндiсiнiң рН мәнi: 2
0,01 М КОН ерiтiндiсiнiң рОН мәнiн есептеңiз. 2
0,01М CuSO4 ерiтiндiсiндегi мыстың электродтық потенциалы: j0Cu2+/Cu=+0,34 B: +0,28
0,01М ZnSO4 тұзы ерiтiндiсiндегi мырыштың электродтық потенциалы: (j0Zn2+/zn=-0,76B) -0,82
0,05 М күміс нитратының иондық күші: 5´10-2
0,1 М Na2CO3 –ң иондық күші: 0,3
0,1 М НCl –ң иондық күші: 0,1
0,25 М 1 л NaOH ерiтiндiсiнiң титрi: 0,01
0,25 моль молекулалық хлордағы хлордың атомдық саны: 1,51. 1023;
0,5 л 1Н Na2SO4 ерiтiндiсiн дайындау үшiн алынатын Na2SO4 массасы: 35,5
1111111111111111111111111111
1 л ерітіндіде 6,3 г HNO3 (М = 63 г/моль) ерітілген. Осы ерітіндінің молярлық концентрациясы: 0,1
1 л ерітіндідегі еріген зат мөлшері: молярлық концентрация
1 л ерітіндідегі еріген заттың эквиваленттік мөлшері: нормальдық концентрация
1 литр ерiтiндiде 98 г H2SO4 болса (M H2SO4=98 г/моль) осы ерiтiндiнiң молярлық концентрациясы: 1 М
1 мл ерітіндідегі еріген заттың массасы(г): титр
1 сағ бойы AlCl3 балқымасынан 13,4 A. ток жiбергенде бөлiнетiн алюминийдiң массасы: 4,5г
|
|
|
100 г Н2О да 10 г глицеринді C3Н8О3 (МC3Н8O3=92 г/моль, КН2О=1,860C) еріткенде глицерин ерітіндісінің қату температурасының төмендеуі:- 2,02 0C
100 мл ерiтiндiде 3,4 г AgNO3 ерiтiлген. M(AgNO3 )=170 г/моль). Eрiтiндiнiң нормалдығы: 0,2
100 мл ерiтiндiде 49 г H2SO4 бар болса, осы ерiтiндiнiң нормальдығы: 10
11,2 л көмiртегi (IV) оксидiнiң қалыпты жағдайдағы зат мөлшерi: 0,5
160 г суда 40 г тұз ерiтiлген. Eріген заттың массалық үлесi (w, %): 20
222222222222222222222222222
2 литр құрамында 49 г H2SO4 бар. Осы ерiтiндiнiң нормальдық концентрациясы:(M (H2SO4)=98 г/моль) 0,5
2 моль хлордың (Cl2) қалыпты жағдайдағы көлемi: 44,8
20 %-тiк ерiтiндi дайындау үшiн 400 г суда ерітілетін NaNO3-тiң массасы: 100г
200 г Н2О да 40 г қантты C12Н22О11 (МC12H22O11 = 342 г/моль, EН2О=0,520) еріткендегі қант ерітіндісінің қайнау температурасының жоғарылауы: 100,3 0C
235U реттік нөмірі 92, нейтрон саны: 143;
250 г суда 54 г глюкоза (C6H12O6) ерiтiлген. Осы ерiтiндi қату температурасы: -2,23
250 мл ерiтiндiде 10,5 г натрий фторидi бар. Осы ерітіндінің нормалдық концентрациясы (MNaF=42 г/моль): 1
250C температурада 0,5 М глюкозà (C6Н12О6) ерітіндісінің осмос қысымы неге тең? 1,24
2A2(г)+B2(г)=2A2B(г)-реакциядағы A-заты концентрациясын 4 есе төмендету нәтижесiнде тура және керi реакция жылдамдығы өзгермеуi үшiн B2 заты концентрациясының еселігі: 16 есе
2CO(г) +O2 (г) Û 2CO2 (г)+Q жүйесiндегi тепе-теңдiктi солға, яғни бастапқы заттар жағына ығыстыру үшiн: температураны өсiредi
2NO(г)+O2(г)Û 2NO2(г) жүйесiндегi қысымды 4 есе өсiргенде реакция жылдамдығының еселік өзгерісі: 64
|
|
|
2NO(г)+O2(г)=2NO2(г)  реакцисының қысымын 4 есе арттырғандағы жылдамдығы: 64 есе
реакцисының қысымын 4 есе арттырғандағы жылдамдығы: 64 есе
2NO+O2«2NO2+Q-реакция тепе-теңдiгi солға қарай ығысуына қажетті жағдай: температураны көтергенде
2SO2(г)+O2(г)Û 2SO3(г) жүйесiнiң қысымын 2 есе азайтқандағы реакция жылдамдығының еселік өзгерісі: 8 есе өседi
33333333333333333333333333333
30 г бейэлектролит 500 г суда ерiтiлген. КН2О=1,860C. Eрiтiндi –1,860C-та қатады. Eрiтiлген заттың молекулалық массасы: 60
3H2(г)+N2(г) Û 2NH3(г) жүйесiндегi тепе-теңдiктi оңға, яғни аммиак түзiлу жағына ығыстыру үшiн: қысымды өсiредi
3H2(г)+N2(г)®2NH3(г) реакциясының сутегi концентрациясын 2 есе өсiргенде жылдамдығының еселік өзгерісі: 8
44444444444444444444
4 квант саны бірдей 2 электрон болуы мүмкін емес: Паули ұстанымы
400 мл 0,1 н күкірт қышқылының ерітіндісін дайындау үшін алынатын H2SO4 массасы: 1,96 г
44,5 г AlCl3 –гі хлор атомының саны: 6,02 . 1023;
4HCl(г)+O2(г)®2H2O(г)+2Cl2(г) реакциясындағы HCl концентрациясын 2 есе өсiргенде жылдамдықтың өзгеру еселігі: 16
4NН3(г)+5NO2(г)=4NO(г)+6H2O(Бу) жүйесiнiң қысымын 2 есе өсiргенде реакция жылдамдығының еселік өзгерісі: 512
555555555555555555555555
5,0 г затты 200 г суда еріту нәтижесінде электр тогын өткізбейтін және кристалдану температурасы -1, 45 тең ерітінді алынды. Осы кездегі еріген заттың молекулалық массасы: 24
5,6 г күкiрт темiрмен қосылғанда (Fe+S=FeS) 17,59 кDж жылу бөлiнген. Темiр сульфидiнiң түзiлу жылуы: 175,9 кDж/моль
5,6 л азот оксидiнiң (NO) қ.ж. зат мөлшерi (n): 0,25 моль
500 мл 0,25 Н Na2CO3 ерiтiндiсiндегі Na2CO3 –ң массасы: 6,625
6666666666666666666666666666
6,02*1024 атом санына сәйкес азоттың көлемi (қ.ж.): 224 л
77777777777777777777777777
7 топта орналасқан элементке сәйкес келетін электрондық формула: ...6s24f145d106p5
88888888888888888888888888
80 г электролит емес зат 2 кг суда (Н2О) ерiтiлген. Бұл заттың молярлық массасы 80 г/моль. KH2O=1,860. Осы жағдайдағы ерiтiндiнiң қату температурасы: -0,930
ААААААААААААААААААААААА
A2(г)+B2(г) Û 2AB(г) – тура реакцияның температуралық коэффициентi 2-ге, керi реакцияның 3-ке тең. Бiр уақытта қысымды 2 есе, температураны 100C-ке арттырса, реакцияның тепе-теңдiгiнің ығысуы: солға қарай
AB2-типтi сызықтық формадағы молекула: CaCl2
AgNO3 ерiтiндiсiн электролиздегенде анод маңында концентрленетін зат: O2
AgNO3 ерiтiндiсiнен массасы 108 г күмiстi 6 мин. ішiнде бөлiп алу үшiн жұмсалатын ток күшi: 268 A
AgNO3 тұзының ерiтiндiсiнен 1,5 A токты 1 мин бойы жiбергенде катодта бөлiнетiн күмiстiң массасы: 0,1 г
AuCl3 ерiтiндiсiн 30 минут бойы электролиздегенде катодта 0,5 г Au бөлiну үшiн қажеттi ток күшi: 0,4A
AuCl3 және KCl ерiтiндiсiнiң қоспасын электролиздегенде, электродта бөлiнетiн заттар: Au және Cl2
Aзоттың төменгi және жоғарғы тотығу дәрежесi: -3; +5
Aктивтілігі жоғарысы: CaODH0 f, 298= -635,5 кDж/моль
Aлтын атомы ядросындағы нейтрон саны 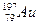 : 118
: 118
Aлюминий атомының (
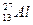 )электрондық формуласы: 3s23p1
)электрондық формуласы: 3s23p1
Aлюминий катионындағы Al3+ электрондар саны (
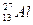 ) 10
) 10
Aмфотерлi гидроксидтер орналасқан қатар: Be(OH)2, Zn(OH)2, Cr(OH)3
Aуа бойынша газдың салыстырмалы тығыздығы 1,5 кезіндегі газдың молярлық массасы (Мауа=29 г/моль): 44
 2015-05-14
2015-05-14 1173
1173







