При детальном рассмотрении рентгеновского спектра, обнаруживается не одна линия Кa, а две, обозначенные Кa1 и Кa 2. В L -серии наблюдается целый набор (5 -7) линий Lb. Чтобы объяснить такую структуру спектра, необходимо рассмотреть более сложную схему рентгеновских уровней с учетом их расщепления на подуровни в соответствии с квантовыми числами.
Все внутренние слои, и подслои атома заполнены, и суммарные квантовые числа для них имеют значения L= 0, Sms = 0. М=1
При удалении одного электрона из внутреннего подслоя его суммарные квантовые числа приобретают другие значения, и энергия уровня определяется энергией выбитого электрона, т.е. L= l (l - орбитальное квантовое число удаленного электрона), Sms = Sms.
Например: рассмотрим значения суммарных квантовых чисел атома молибдена.
42Mo 1s2 2s2p6 3s2p6d10 4s2 p6d54s1.
К- слой 1s2 (заполненный полностью) L= 0, Sms = 0.
К-слой, соответствующий К- рентгеновскому уровню 1s1 - (L=0, Sms = 1/2. М=2)
Для полного описания уровня следует ввести еще одно квантовое число - ј (джи) - суммарное внутреннее квантовое число.
Суммарное внутреннее квантовое число может принимать положительные значения: ј = L + Sms и L- Sms
Для К-уровня (1s1) L=0; Sms= ½; М=2; ј =1/2. Полное обозначение этого уровня 12S1/2 (В нижнем правом углу у символа уровня указано значение внутреннего квантового числа)
L- электронный слой состоит из двух подслоев, которые состоят из электронов:
2s2 L=0; Sms=0; j = 0 и
2р6 L=0; Sms=0; j = 0
L - уровень расщеплен на подуровни S и P.
S - подуровень соответствует энергии атома, из L-слоя которого выбит один s-электрон, (конфигурация электронных оболочек при этом 2s1p6). Суммарные квантовые числа этого подуровня: L=0; Sms=1/2; M=2; ј =1/2
Обозначение подуровня - 2 2S1/2
Р - подуровень - соответствует энергии атома из L- слоя, которого удален р-электрон. Электронная конфигурация L- слоя при этом - 2s2p5. При этом Р подуровень расщепляется еще на две составляющие с разным значением внутреннего квантового числа.
Суммарные квантовые числа: L=1, Sms=1/2, M=2, ј =1/2 (L- Sms)
Обозначение подуровня: 2 2P1/2
L=1; Sms=1/2; M=2; j =3/2 (L+ Sms). Обозначение: 2 2P3/2
В конечном счете L- уровень оказывается расщепленным на три подуровня. (см. Рис. 2)
Еще сложнее оказывается М-уровень.
Конфигурация М-слоя в атоме - 3s2p6d10.М- электронный слой состоит из трех подслоев - s, p, d.
В зависимости от того, из какого подслоя выбит электрон при получении рентгеновского спектра М - энергетический уровень расщепляется на пять подуровней (смотри Рис. 2).
М-слой. 3s2p6d10.
М-уровень:
1. 3s1p6d10 (удален 3s1 - электрон) L=0; Sms=1/2; M=2; ј = 1/2 (32S1/2)
2. 3s2p5d10 (удален 3p - электрон) L=1; Sms=1/2; M=2; ј = 1/2 (32P1/2)
3. 3s2p5d10 (удален 3p - электрон) L=1; Sms=1/2; M=2; ј = 3/2 (32P3/2)
4. 3s2p6d9 (удален 3d - электрон) L=2; Sms=1/2; M=2; ј = 3/2 (32D3/2)
5. 3s2p6d9 (удален 3d - электрон) L=2; Sms=1/2; M=2; ј = 5/2 (32D5/2)
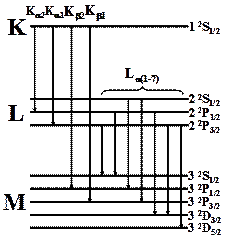
Рис.2. Схема рентгеновских энергетических уровней и переходов между ними.
Переходы между уровнями подчиняются правилам отбора:
Dn>0 т.е. запрещены переходы в пределах одногоэнергетического уровня. (Главное квантовое число должно обязательно изменяться).
DL = ±1 т.е. Наиболее вероятными являются переходы: S«P «D «F
D ј = 0, ±1
 2015-05-20
2015-05-20 823
823








