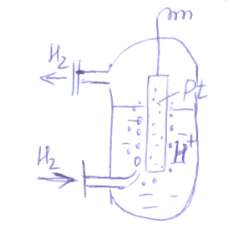
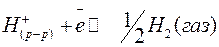
включает 3 стадии:
1. Адсорбция молекулярного водорода на платине 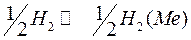 ;
;
2. Диссоциация адсорбированных молекул на атоме, каталитически ускоряемую платиной 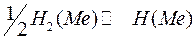 ;
;
3. Ионизация атомарного водорода и переход его в раствор 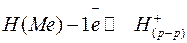
Третья стадия определяет возникновение электродного скачка потенциала и поэтому называется потенциалопределяющей. Таким образом, устанавливается равновесие между ионами водорода в растворе и газообразным водородом.
Водородный электрод записывается следующим образом:
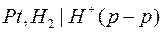
Электродный процесс: 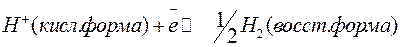
Электродный потенциал водородного электрода запишется по уравнению Нернста:
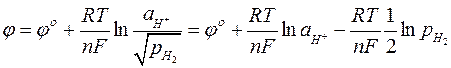
Так как парциальное давление водорода равно единице 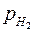 =1,то это выражение упрощается:
=1,то это выражение упрощается:
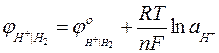
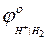
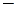 стандартный потенциал водородного электрода при активности ионов водорода
стандартный потенциал водородного электрода при активности ионов водорода 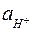 =1, в условиях, когда давление газообразного водорода равно единице
=1, в условиях, когда давление газообразного водорода равно единице 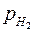 =1, а температура равна 289К, принят за нуль (
=1, а температура равна 289К, принят за нуль (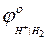 =0).
=0).
Электродный скачок потенциала в условной шкале водородного электрода называется электродным потенциалом и означается через 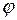 . Он равен ЭДС электрохимического элемента, состоящего из стандартного водородного и данного электродов. Запись такого элемента всегда начинается с водородного электрода, т.е. он считается левым.
. Он равен ЭДС электрохимического элемента, состоящего из стандартного водородного и данного электродов. Запись такого элемента всегда начинается с водородного электрода, т.е. он считается левым.
 2015-05-10
2015-05-10 233
233








