Наряду с практически необратимыми химическими реакциями, известны многочисленные обратимые процессы. В этом случае химическое превращение не доходит до конца, а возникает равновесная смесь всех участников и продуктов реакции, находящихся как в левой, так и в правой частях стехиометрического уравнения реакции. Так, при стандартных условиях обратимой является система:
2NO2(г) 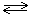 N2O4(г).
N2O4(г).
Для обратимой реакции, которая, в общем виде, имеет вид:
mA + nB 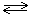 pC + qD,
pC + qD,
согласно закону действующих масс значения скоростей для прямой (V прям) и обратной (V обр) реакций описываются следующими кинетическими уравнениями:
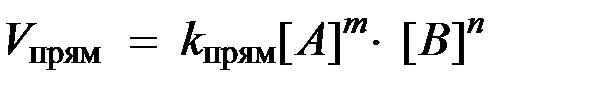
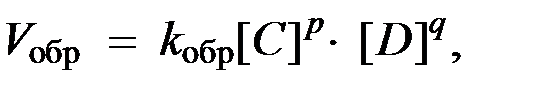 где:
где:
k прям и k обр - константы скорости, соответственно, прямой и обратной реакций.
В начальный момент времени концентрации исходных веществ [A] и [B], а следовательно, и скорость прямой реакции имеют максимальное значение. Концентрации продуктов реакции [С] и [D] и скорость обратной реакции в начальный момент равны нулю. В ходе реакции концентрации исходных веществ уменьшаются, что приводит к снижению скорости прямой реакции. Концентрации же продуктов реакции, а, следовательно, и скорость обратной реакции возрастают. Наконец, наступает момент, при котором скорости прямой и обратной реакций становятся равными.
Состояние системы, при котором скорость прямого процесса равна скорости обратного процесса (Vпрям = Vобр) называется химическим равновесием. Это равновесие является динамическим, поскольку в системе имеет место двусторонняя реакция - в прямом (A и B - реагенты, C и D - продукты) и в обратном (A и B - продукты, C и D - реагенты) направлениях.
В обратимой системе, находящейся в состоянии равновесия, концентрации всех участников процесса называются равновесными концентрациями .
Количественную характеристику химического равновесия можно вывести, используя соответствующие кинетические уравнения:
V прям = V обр,
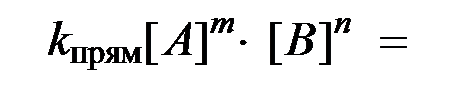
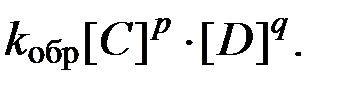
Так как константы скоростей реакций при фиксированной температуре постоянны, то будет постоянным и отношение
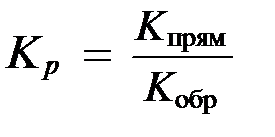 ,
,
которое называют константой химического равновесия.
Приравнивая правые части кинетических уравнений для прямой и обратной реакций можно получить:
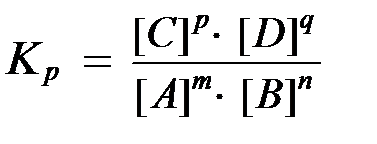 ,
,
где Kр - константа химического равновесия, выраженная через равновесные концентрации участников реакции.
Константа химического равновесия представляет собой отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов.
Например, для обратимой реакции
2NO2(г) 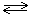 N2O4(г)
N2O4(г)
выражения для константы равновесия имеет вид:
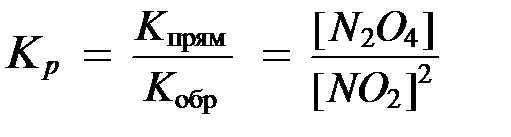 .
.
Если в процессе химического превращения участвуют две или несколько фаз, то в выражении для константы равновесия следует учитывать только те из них, в которых происходят изменения концентраций реагентов. Например, в выражение для константы равновесия для системы
CaCO3(т) 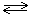 CaO(т) + CO2(г)
CaO(т) + CO2(г)
твердые вещества не включаются
Кр = [CO2].
Константа равновесия Kp - количественная мера способности реакции протекать «слева - направо» при заданном способе написания стехиометрического уравнения реакции.
 2015-05-10
2015-05-10 850
850








