Структура чистых оксидов. Структура чистых оксидов зависит от размеров катионов и анионов и типа связи между ними.
А. Влияние размеров ионов на структуру
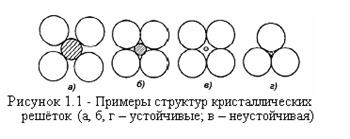
Структура твердого оксида относительно проста: металлические катионы окружены ионами кислорода в трехмерной кристаллической решетке. Первый закон Полинга гласит, что каждый катион должен быть окружен максимальным числом анионов кислорода в структуре с плотной упаковкой. Это число называется "координационным числом" и зависит только от размеров и зарядов аниона и катиона. На рисунке 1.1 приводятся примеры устойчивых и неустойчивых структур.
В вертикальных столбцах таблицы Менделеева атомные радиусы элементов возрастают сверху вниз, поскольку возрастает число электронных оболочек. В горизонтальном ряду, радиусы уменьшаются слева направо, так как каждый электрон данной оболочки притягивается большим числом протонов в ядре. В случае ионов радиус зависит не только от радиуса соответствующего атома, но и от его заряда. Так, например, радиусы анионов намного больше радиусов катионов. Ион Fe3+, являющийся атомом железа, потерявшим три электрона, меньше иона Fе2+, потерявшего два электрона. В таблице 1.1 приводятся радиусы наиболее известных ионов.
Таблица 1.1 - Радиусы катионов (Rк) и анионов (Ra), ангстрем (Ǻ)
| Катион | Ca2+ | Mn2+ | Fe2+ | Mg2+ | Mg2+ | Al3+ | Si4+ | Анион | O2- | S2- | F- |
| Rк | 0.93 | 0.80 | 0.75 | 0.60 | 0.65 | 0.50 | 0.41 | Ra | 1.40 | 1.84 | 1.36 |
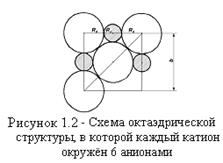
Предельное отношение Rк/Ra для любой устойчивой структуры можно определить, рассмотрев её строение. Для октаэдрической структуры, в которой все ионы находятся в контакте, (рисунок 1.2):
b = 2(Rк + Ra) и
b√2 = 4Ra
Следовательно, предельное значение Rк/Ra равно 0,414. При меньшем отношении, то есть, при меньшем размере катион, октаэдрическая структура не будет устойчивой.
Таблица 1.2 - Примеры структур с координационными числами
| Структура | Координационное число | Rк/Rа | Примеры |
| Кубическая | 1 – 0.732 | ||
| Октаэдрическая | 0.732 – 0.414 | CaO, MgO, MnO, FeO | |
| Тетрагональная | 0.414 – 0.225 | SiO2, P2O5 | |
| Триангулярная | 0.225 – 0.155 |
В таблице 1.2 приводятся возможные структуры с соответствующими координационными числами и отношениями Rк / Ra. Катионы с большими радиусами (Са2+ до Мg2+) в окcидах имеют октаэдрическую структуру с координационным числом 6, а оксиды с меньшими катионами (Si4+, Р5+, А13+ и т.д.) - тетраэдрическую.
Элементарные тетраэдры кремнезема могут соединяться тремя способами: гранями, сторонами или вершинами (рисунок 1.3). Второй закон Полинга гласит, что расстояния между соседними катионами должны быть максимальными, так как они взаимно отталкиваются.
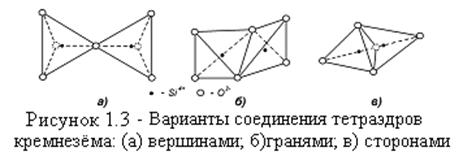
Следовательно, тетраэдры соединяются вершинами, и образуют объёмную (трёхмерную) гексагональную конфигурацию. Каждый атом кремния связан с четырьмя атомами кислорода и каждый атом кислорода связан с двумя атомами кремния, что дает структурную формулу (SiO2)n, или просто - SiO2.
Во время плавки кристаллическая структура оксидов разрушается, связи между ионами разрываются тепловой энергией. В этих условиях, катионы все еще окружены анионами, но в менее жесткой форме, и их координационное число может изменяться. При прочных связях между катионами и анионами (как в случае кремнезема) тетраэдрическая кристаллическая структура не изменяется во время плавки. При увеличении температуры выше точки плавления, связи между тетраэдрами разрушаются в возрастающей степени. Сначала, образуются крупные ионы, такие как (Si9O21)6-, и небольшое количество Si4+. Затем, по мере разрушения связей в кристаллической структуре размеры комплексных ионов уменьшаются. Появляются ионы (Si3O9)8-, продолжает расти число катионов Si4+. При очень высокой температуре тетраэдры отделяются друг от друга, и выравнивается число анионов SiO44- и катионов Si4+. Переход от твердого кремнезема к вязкой жидкости осуществляется в несколько этапов с неопределяемой точкой плавления - плавный переход от бесконечной вязкости к конечным её значениям.
Силы связи между металлом и кислородом. Основные типы связей в кристаллах: электровалентная и ковалентная. При электровалентных связях металлический атом отдает один или несколько электронов атому кислорода, превращаясь в катион и превращая атом кислорода в анион О2-. Сила притяжения между анионами и катионами, сила Кулона, возрастает по мере возрастания зарядов ze и z’e катионов и анионов и по мере уменьшения расстояния между ионами противоположного знака заряда. Заряд ионов кислорода - 2е, расстояние между ионами (Ra + Rк,) и закон Кулона можно выразить в форме: F = 2ze2/(Rк + Rа)2
Элементы в первом столбце таблицы Менделеева (щелочные металлы) имеют меньшее число единичных зарядов, чем элементы в следующих столбцах, и их ионные радиусы больше. Следовательно, силы электровалентной связи между этими катионами и кислородными анионами будут большими, чем у элементов следующих столбцов. Большие координационные числа катионов еще больше ослабляет силу связи (из-за их размеров), так как эта сила должна распределяться между большим количеством ионов кислорода. Во втором столбце таблицы 1.3 для ряда оксидов дается отношение Z/(Ra + Rк)2, пропорциональное силам притяжения между ионами.
Центральные элементы в таблице Менделеева с размерами, промежуточными между щелочными металлами и галогенами, не теряют и не захватывают периферийные электроны с такой легкостью, как краевые элементы. Их связи с кислородом в основном ковалентные - оба элемента делят между собой свои периферийные электроны. Сила связи между атомами, образующими ковалентную молекулу, очень велика и для разрыва таких связей требуются высокие температуры. Однако, силы связи между молекулами слабее, чем и объясняется газообразное состояние значительного числа чисто ковалентных оксидов (СО2, SО2).
Таблица 1.3 - Типы связи и силы притяжения катиона и аниона О2-
| Оксид | Z/(Rк + Rа) | Доля ионной связи | Координационное число | Характер оксидов | |
| Твёрдый | Жидкий | ||||
| Na2О | 0.18 | 0.65 | От 6 до 8 | Сеткоразрушители Модификаторы Основные оксиды | |
| BаО | 0.27 | 0.65 | От 8 до 12 | ||
| SrО | 0.32 | 0.61 | |||
| CaO | 0.35 | 0.61 | |||
| MnO | 0,42 | 0.47 | От 6 до 8 | ||
| FeO | 0.44 | 0,38 | |||
| ZnO | 0.44 | 0.44 | |||
| MgО | 0.48 | 0.54 | |||
| BeO | 0.69 | 0.44 | |||
| Cr2O3 | 0.72 | 0.41 | Амфотерные оксиды | ||
| Fe2O3 | 0,75 | 0.36 | |||
| Al2O3 | 0.83 | 0.44 | От 4 до 6 | ||
| TiO2 | 0.93 | 0.41 | Сеткообразователи Кислые оксиды | ||
| SiO2 | 1.22 | 0.36 | |||
| P2O5 | 1.66 | 0.28 |
Оксидов с чисто ионным или чисто ковалентным типом связи не существует. Имеется определенное соотношение связей обоих типов; ионная доля связи возрастает от оксида фосфора к оксиду натрия. Эта доля является косвенной мерой степени электролитической диссоциации оксидов на простые ионы в жидком состоянии.
В таблице 1.3 приводятся доли ионных связей между различными катионами и анионами кислорода для некоторых оксидов. Эта доля уменьшается по мере возрастания кулоновского притяжения между ионами. В последней группе оксидов таблицы связь в основном ковалентная, но со значительной электровалентной долей, так как катион невелик и несет большой заряд с координационным числом 4. По этим причинам, связь между катионами и анионами О2- сильна, и простые ионы группируются, образуя комплексные ионы, такие как SiO44- и РO43-.
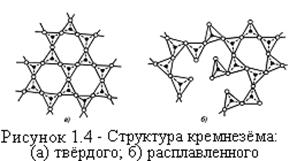
В шлаках эти ионы стремятся к образованию устойчивой гексагональной структуры (рисунок 1.4). Поэтому, их называют "формирователями структуры" (сеткообразователями). Сеткообразователями являются кислые оксиды. Когда основные оксиды плавятся, или растворяются в жидком шлаке, образуются простые ионы, такие как Са2+ и О2-. Эти оксиды разрушают гексагональную структуру кремнезема, реагируя с ним и поэтому называются "разрушителями структуры" (модификаторами).
Когда металл имеет две валентности и может образовывать два оксида, то катион с меньшей валентностью будет по размеру большим. Связь между металлом и кислородом в соответствующем оксиде будет в большей степени электровалентной и, следовательно, этот оксид будет проявлять более основные свойства по сравнению с оксидом большей валентности. Например, железо образует два оксида: Fe2O3 (кислый) и FеО (основной). Магнетит Fе3О4 образуется в результате реакции между основным окислом FeO и кислым Fe2O3.
Таблица 1.3 дает шкалу притяжений между элементами и кислородом. Притяжение есть функция размеров ионов и их зарядов и его нельзя смешивать со сродством элемента к кислороду, которое является термодинамической характеристикой молекулы, но не кристалла. Ионная доля связи между металлом и кислородом не показывает степени электролитической диссоциации в жидких шлаках. В расплавленном состоянии диссоциация основных оксидов на ионы неполная. Однако, степень диссоциации основных оксидов больше, чем кислых, и в значительной степени зависит от ионизирующей способности кислых оксидов, присутствующих в шлаке.
 2015-05-12
2015-05-12 1338
1338








