Термодинамическое поведение компонентов шлака явилось предметом многих исследований и имеется несколько теорий (механическая; химическая; молекулярная и ионная), пытающихся объяснить это поведение. Важнейшим из них являются ионные теории и молекулярные теория. Однако, ни одна теория не отражает действительность в полной степени и часто эти теории трудно трудноприменимы. По этим причинам активность компонента шлака приходится определять экспериментально.
Ионная теория позволяет теоретически обосновать металлургические процессы, протекающие с участием основных шлаков. Согласно этой теории химические соединения в расплавленном состоянии в большей или меньшей степени диссоциируют электролитически:
FeO ↔ Fe++ + O--
Fe2SiO4 ↔ 2Fe++ +SiO-4
Константа равновесия реакции определится уравнением: 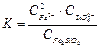 .
.
В кристаллическом виде оксиды состоят из ионов. Рентгеноструктурное изучении ряда расплавленных соединений показало, что и жидком виде сохраняются ионы, которые наблюдаются в твердом состоянии. Это дало возможность считать, что оксиды и соединения в расплавленных шлаках имеют ионную, а не молекулярную природу. Впервые применение ионных представлений к шлакам было сделано В.А. Ванюковым в 1912 – 1916 гг.
Подтверждением ионной теории является электролиз глинозема - Al2O3 а получением Al и O2, а также повышение электропроводности жидких шлаков с повышением температуры.
Основу большинства шлаков составляют шлаков силикаты. Химические превращения, протекающие при введении в основной шлак SiО2, рассмотрим на примере поведения СаО. Диссоциация СаО в расплавленном шлаке происходит по реакции: (CaO) ↔ (Ca2+) + (O2-)
При введении в систему SiО2 анион O2- присоединяется к молекуле SiО2, образуя простейший анион на основе SiО2: SiО2 + 2О2- = SiО44-. В расплаве при этом будут присутствовать катионы Са2+ и анионы SiО44-. При увеличении концентрации SiО2 ионы SiО44-будут соединяться между собой, образуя полимерные цепочки: SiО44- + SiО44- = Si2О76-; Si2О76- + SiО44- = Si3О108-; и т.д. (рисунок 2.1).
Природные силикаты в зависимости от соотношения в них О/Si образуют различные структуры. В природном кварце (SiО2) отношение О/Si равно 2/1, и он представлен в тетрагональной форме, как бесконечная, объёмная, трёхмерная, полимеризованная структура. В каолините (AI2Si2O5(OH)4), где отношение О/Si равно 5/2, часть полимерных связей разрушена. Взамен разрушенной бесконечной трёхмерной связи Si–O–Si–O-Si–O-Si–O образуется связь Si–O–Si–O-Ме. Основной металл не имеет способности к полимеризации, связи разрываются, и элементарные тетраэдры соединяются в плоскости (двухмерные или пластинчатые структуры).
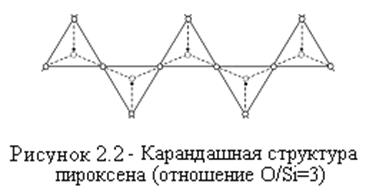
Несоединенные между собой вершины тетраэдров соединены с октаэдрами алюминия. Пластинчатые структуры слюды объясняют легкость, с которой она разделяется на слои.
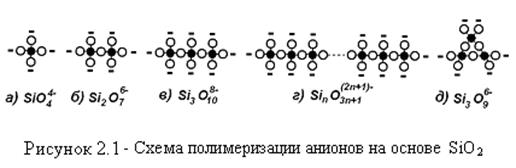
Пироксен МgO·SiO2 имеет отношение О/Si равное 3/1 и образует волокнистую, нитевидную, карандашную структуру (рисунок 2.2) К этому типу относится и асбест.
Фаялит Fe2SiO4 (отношение О/Si равно 4/1), является силикатом, в котором разрушены все полимерные связи тетраэдральной или гексагональной структуры. Это соединение кристаллизуется в форме, представленной на рисунке 7. Все тетраэдры разделены ионами Fe2+. При плавлении силикатов хорошо определима точка плавления.
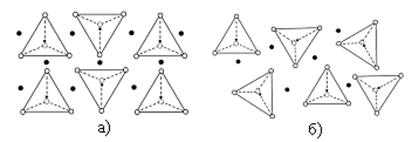
Рисунок 2.3 – Структура фаялита – Fe2SiO4:
а) твердого; б) расплавленного
Электровалентные связи между катионами и комплексными анионами, SiO44- являются более слабыми и разрушаются первыми. При повышении температуры силикатная структура полностью разрушается (рисунок 2.3).
У оксидов в узлах кристаллической решетки расположены катионы металлов и атомы О2, у силикатов - катионы металла и сложные анионы, составленные из атомов кислорода и кремния. В том случае, когда О: Si = 2, т.е. мы имеем SiO2, решетка представляет собой бесконечную трехмерную сетку, составленную из кремнекислородных тетраэдров SiO4 с общими вершинами. Каждый атом кислорода, расположенный в вершине, соединен с двумя атомами кремния, расположенными в центрах соседних тетраэдров. Т.о. все валентности O2 и Si полностью взаимно насыщены.
В состав металлургических шлаков наряду с SiO2 входит то или иное количество других окислов. В связи с этим отношение О: Si обычно больше двух. Когда оно достигает 2.5, тогда в решетки содержаться плоские сетки тетраэдров, бесконечно распространяющиеся в двух направлениях. По мере добавления кислорода ведет к образованию одномерных цепочек, и, в конечном счете, к разрыву их.
Наиболее распространенные из структур являются (Si3O96-), (Si4O128-), (Si6O1812-)/
Предельного дробления кремнекислородные комплексы достигают тогда, когда атом кремния окружен четырьмя однозарядными атомами кислорода, что соответствует ортосиликату SiO44-.
Аналогичный характер строения имеют расплавы других кислотных окислов.
Химические связи кремния с кислородом и кремнекислородных тетраэдров имеют между собой ковалентный характер, а связи кремнекислородных атомов с простыми металлическими катионами являются ионными связями.
Наиболее убедительными доказательствами ионной природы шлаков является их поведение под действием электрического тока. При прохождении постоянного тока через шлак на электродах получаются продукты электролиза. Это используется при электролизе Al2O3 с получением металлического алюминия.
Электропроводность шлаков носит ионных характер: с ростом температуры она у шлаков увеличивается, тогда как у металлов (электрона) уменьшается.
Расчет распределения серы между металлом и шлаком с позицией ионной теории дал удовлетворительное совпадение с показателями реального процесса.
При расчетах равновесий в шлаках со значительным количеством кислотных оксидов необходимо допускать возможность существования в шлаке сложных кислотных анионов: SiO44-, PO43-, AlO2-. Константа равновесия в этом случае при диссоциации фаялита - Fe2SiO4 – выразится:
К = 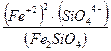 ,
,
при его диссоциации по реакции Fe2SiO4 ↔ 2Fe+2 + SiO44-
В сложных реальных шлаках присутствуют, однако, не только ионы, но и химические соединения.
Теория Темкина
Теория Темкина утверждает, что шлаки являются растворами, полностью диссоциированными на ионы, находящиеся в совершенно хаотическом состоянии; взаимодействие между ионами с одинаковым зарядом отсутствует. Предполагается, что растворы солей или оксидов состоят из двух идеальных растворов: раствора катиона i+ и раствора аниона i-. Приминая эту гипотезу, можно записать:
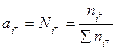 (2.1)
(2.1)
и
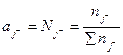 (2.2)
(2.2)
Для определения стандартного состояния компонента i и j рассматривается равновесие следующей реакции:
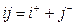 (2.3),
(2.3),
свободная энергия которой (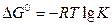 ), следовательно, равна нулю.
), следовательно, равна нулю.
Если за стандартное состояние принять чистый компонент в равновесии с его ионам, то стандартная свободная энергия будет равна нулю, и К=1:
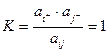 (2.4)
(2.4)
или, согласно (6.11) и (6.12):
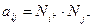 (2.5)
(2.5)
Предполагается, что последнее отношение действительно независимо от мольной доли компонента ij в растворе.
Обычно, в шлаках в растворе содержаться следующие ионы:
Ca2+, Mg2+, Fe2+, SiO44-, PO43-, Al2O42-, Fe2O54-,O2- и т.д. Долю ионов в шлаке, представленную O2-, можно рассчитать из (2.5 a)
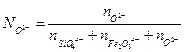 (2.5a),
(2.5a),
долю Ме2+ из (2. 5б)
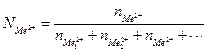 (2.5б),
(2.5б),
и активность оксида из (2.5).
Пример:
Рассчитаем активность FeO в шлаке со следующим молярным составом:
CaO - 0.339 SiO2 - 0.016
MgO - 0.114 Fe2O3 - 0.064
FeO - 0.467
Раствор (предположительно совершенно ионизированный) будет содержать катионы Ca2+, Mg2+ и Fe2+ и анионы SiO44-, Fe2O54- и O2-. Активность FeO по (6.15):
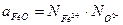
Катионная доля Fe2+ равна:
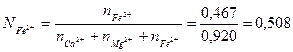
Число анионов О2- и долю анионов, которую они представляют, можно рассчитать, используя (2.5а):
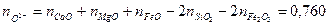
и
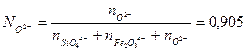
Таким образом, активность FeO в шлаке будет:
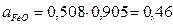
Коэффициент активности FeO в этом шлаке (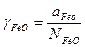 ) несколько меньше единицы, что нормально для основного шлака с низким содержанием кремнезема.
) несколько меньше единицы, что нормально для основного шлака с низким содержанием кремнезема.
Применение теории Темкина предполагает, что все виды ионов в шлаке известны. В сильноосновном шлаке (как в выше приведенном примере), несомненно, образуются простые анионы SiO44-, но вполне возможно, что в кислом шлаке в растворе существуют ионы Si2O76-, Si3O108- и т.д. В таких условиях, применение этой теории затруднено.
Лекция 3. Теория Флуда
В теории Флуда, Форланда и Гретгейма, отчасти основывающейся на теории Темкина, рассматривается равновесие между растворенными в металлической фазе элементами и их соединениями, или ионами, в шлаке. Например, серно–кислородное равновесие между металлом и шлаком:
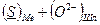 D
D 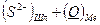 (3.1)
(3.1)
и постоянная равновесия (1) будет равна:
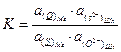 (3.2)
(3.2)
Согласно определению Темкина, активность анионов S2- и O2- равна их анионным долям 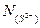 и
и 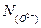 . Следовательно, константа равновесия:
. Следовательно, константа равновесия:
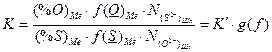 (3.3)
(3.3)
где
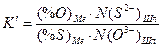 .
.
Константа равновесия 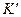 равна K, если отношение коэффициентов активности
равна K, если отношение коэффициентов активности 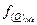 и
и 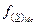 -
- 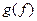 , равно единице.
, равно единице.
В комплексном шлаке возможно присутствие сульфидов и оксидов натрия, кальция, магния, железа, марганца и т.д. Для упрощения предположим, что реагируют только два оксида – например, CaO и Na2O. Тогда, (3.1) можно записать:
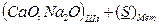 D
D 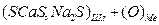 (3.4)
(3.4)
и свободная энергия:
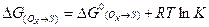 (3.5)
(3.5)
К – константа равновесия, полученная по (3.2). В этом случае (3.4) можно представить следующим образом (по этапам):
1. Разложение оксидов, участвующих в реакции:
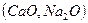 D
D 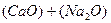 (3.6)
(3.6)
Свободная энергия (6.21) равна 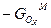 ,и ее можно выразить как функцию мольной доли каждого оксида в растворе и парциальных свободных энергиий:
,и ее можно выразить как функцию мольной доли каждого оксида в растворе и парциальных свободных энергиий:
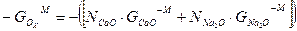 (3.6 а)
(3.6 а)
В этом случае, 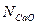 и
и 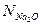 соответственно равны:
соответственно равны:
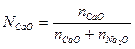 и
и 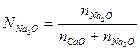
Мольные доли равны «эквивалентным долям» 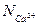 и
и 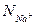 :
:
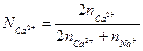 и
и 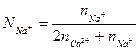
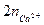 и
и 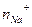 выражают число эквивалентов катиона Ca2+ и Na+ в растворе. (3.6 а) можно записать:
выражают число эквивалентов катиона Ca2+ и Na+ в растворе. (3.6 а) можно записать:
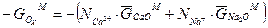 (3.6 б)
(3.6 б)
2 Реакции каждого оксида с серой с образованием сульфидов:
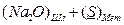 D
D 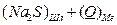 (3.7)
(3.7)
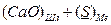 D
D 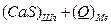 (3.7 а)
(3.7 а)
Свободная энергия превращения 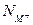 молей каждого оксида в сульфид будет:
молей каждого оксида в сульфид будет:
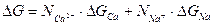 (3.7 б)
(3.7 б)
где 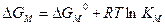 и
и 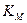 – постоянная равновесия (6.22), когда шлак в равновесии с металлом содержит только один вид катиона М+.
– постоянная равновесия (6.22), когда шлак в равновесии с металлом содержит только один вид катиона М+.
3. Растворение сульфидов
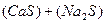 D
D 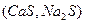 (3.8)
(3.8)
свободная энергия смешивания ровна:
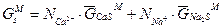 (3.8 а)
(3.8 а)
Сумма свободных энергий (3.6), (3.7) и (3.8) равна свободной энергии (3.4), поскольку исходное и конечное состояния одинаковы, то есть:
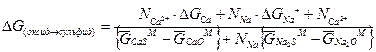 (3.9)
(3.9)
В первом приближении, можно допустить, что парциальные свободные энергии смешивания сульфидов и оксидов незначительные по отношению к свободным энергиям реакции и одинаковы. Тогда, исключаются два последних члена (9), и уравнение упрощается:
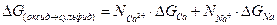 (3.10)
(3.10)
или
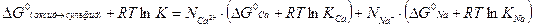 (3.11)
(3.11)
Поскольку стандартная свободная энергия превращения окисла в сульфид равна:
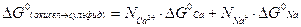
(3.11) упрощается и дает:
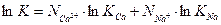 (3.12)
(3.12)
Члены 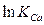 и
и 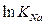 постоянны при данной температуре и их можно обозначить ACa и ANa, соответственно. С другой стороны, К можно выразить как функцию
постоянны при данной температуре и их можно обозначить ACa и ANa, соответственно. С другой стороны, К можно выразить как функцию 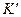 и
и 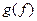 , как в уравнении (3.3). Таким образом, находим отношение между
, как в уравнении (3.3). Таким образом, находим отношение между 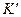 (действительной постоянной равновесия) и электрически эквивалентной долей основного окисла
(действительной постоянной равновесия) и электрически эквивалентной долей основного окисла 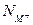 :
:
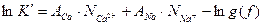 (3.13)
(3.13)
Для равновесия между I компонентами, участвующими в реакции, уравнение (13) остается действительным и его можно обобщить в следующей форме: 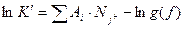 (3.14)
(3.14)
В случае сложных равновесий, таких, как равновесие серы и кислорода в металле и шлаке, участие каждого основного оксида (CaO,MgO, FeO, Na2O и т.д.) пропорционально эквивалентной доле 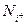 его катиона. Коэффициент пропорциональности
его катиона. Коэффициент пропорциональности 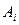 является функцией относительного сродства элементов к кислороду и сере. Уравнение (3.14) применимо к любому типу сложных равновесий.
является функцией относительного сродства элементов к кислороду и сере. Уравнение (3.14) применимо к любому типу сложных равновесий.
Теория Мэссона
Теорией Мэссона можно пользоваться при расчете активности основного окисла в силикатном шлаке. Согласно Мэссону, шлаки являются сложными растворами, содержащими полимерные силикатные анионы. Степень полимеризации зависит от свойств и количества содержащегося в шлаке основного окисла. Так, высокоосновной шлак будет содержать кремнезем, главным образом, в виде 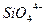 ; более кислый шлак будет содержать следующие ионы:
; более кислый шлак будет содержать следующие ионы: 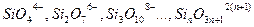 – все во взаимном равновесии. Отдельные равновесия можно записать:
– все во взаимном равновесии. Отдельные равновесия можно записать:
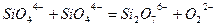 (3.15а)
(3.15а)
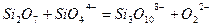 (3.15б)
(3.15б)
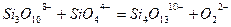 (3.15в)
(3.15в)
Поскольку все эти реакции заключаются в добавлении тетраэдра кремнезема к существующей цепи, в первом приближении можно предположить, что свободные энергии будут, в основном, равны постоянным равновесия Ка, Кб, Кв … и, следовательно:
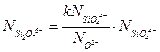 (3.16а)
(3.16а)

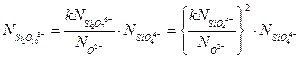 (3.16б)
(3.16б)
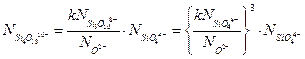 (3.16в)
(3.16в)
(В целях упрощения, каждого заряда иона 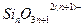 не указывается в выражении ионных долей).
не указывается в выражении ионных долей).
Поскольку сумма ряда 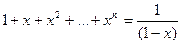 при
при 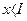 , подставляя
, подставляя 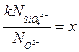 , получим:
, получим:
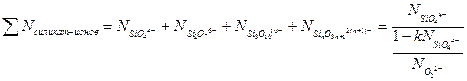 (3.17)
(3.17)
При наличии только ионов силиката и кислорода (как анионов) теория Темкина дает:
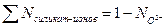 (3.18)
(3.18)
и 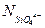 можно рассчитать из (17) и (18) как функцию
можно рассчитать из (17) и (18) как функцию 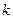 и
и 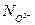 :
:
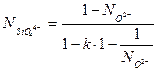 (3.19)
(3.19)
Доли других полимеров силикатных ионов можно рассчитать из равновесий в (16 а, б, в).
Содержание кремнезема определяется химическим анализом и 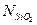 можно соотнести с
можно соотнести с 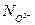 следующим образом:
следующим образом:
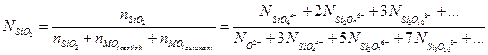 (3.20)
(3.20)
Исходя из того, что сумма ряда 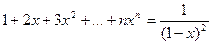 и
и 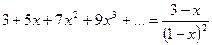 уравнение (20) можно представить в следующей форме:
уравнение (20) можно представить в следующей форме:
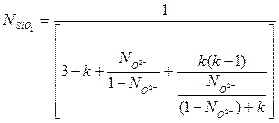 (3.21)
(3.21)
Анионную долю, представленную 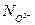 , можно рассчитать из (3.21), если известно k. С помощью отношения Темкина, даваемого (10)
, можно рассчитать из (3.21), если известно k. С помощью отношения Темкина, даваемого (10) 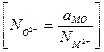 , можно определить активность основного окисла MO.
, можно определить активность основного окисла MO.
Значение активности ряда основных окислов (CaO, FeO, MnO и т.д.) в силикатных шлаках, рассчитанные по этому методу, довольно хорошо согласуются с экспериментальными данными, но теория не применима ко всем шлаковым системам. Это объясняется тем, что постоянные для начальных полимеров Si2O76-, Si3O108- отличаются от постоянных для более сложных членов. Кроме того, теория Мэссона учитывает только линейные цепи (или разветвленные цепи, в других теориях), но, в случае высокополимеров, возможны циклические формы. И, наконец, эта теория, как и теория Темкина и Флуда, предполагает идеальное поведение анионов и катионов раздельно, что далеко не представляет реальную структуру.
 2015-05-12
2015-05-12 1819
1819








