Известно, что вероятность интраоперационного ранения внутренних органов возрастает, если они заполнены и растянуты жидкостью или газом. При эндовидеохирургических вмешательствах этот фактор приобретает гораздо большее значение, чем при лапаротомиях. Поэтому подготовка к плановым операциям требует непременного очищения кишки. В желудок перед началом операции обязательно вводится зонд. Опорожняют мочевой пузырь, оставляя в нем катетер до завершения операции.
Возможность уменьшения риска осложнений начального этапа лапароскопических операций у больных, подвергшихся до этого абдоминальным вмешательствам, зависит прежде всего от правильного выбора места для введения иглы Вереша и первого троакара. Все хирурги сходятся во мнении, что «слепая» пункция брюшной полости недопустима в области послеоперационных рубцов. У пациентов со срединными лапаротомными рубцами большинство авторов предпочитает вводить иглу Вереша в левой половине живота. Ph.Mouret [39], M.Meinero с соавт.[23], E.Estour [23] наилучшим местом для пункции считают точку в левом подреберье по наружному краю прямой мышцы, мотивируя это тем, что сращения, как «спонтанные», так и послеоперационные, в этой зоне обычно отсутствуют, а если и возникают, то в них вовлекается лишь сальник, а не кишка. Того же мнения придерживается G.Berci [ 13], хотя он допускает возможность пункции над пупком после нижнесрединной лапаротомии или под пупком при верхне-срединном рубце. А.С.Балалыкин [9] рекомендует доступ из левой подвздошной области, поскольку в этом отделе живота какие-либо заболевания возникают реже. Тем не менее, все авторы считают возможным ввести иглу Вереша в любом другом месте, удаленном от рубца и зоны предыдущей операции. A.Cuschieri [21] подчеркивает, что эта точка должна быть не ближе, чем в 5 см от любого рубца и лучше всего — в другом квадранте живота. Среди наших пациентов, ранее перенесших операции на органах нижнего этажа брюшной полости, частота неудачных попыток создания пневмоперитонеума иглой Вереша в инфраум-биликальной точке оказалась в 2,5 раза большей, чем при пункции над пупком. По опыту Ph.Mouret и Y.Francois [45], тщательный анализ предыдущих заболеваний и оперативных вмешательств, учет локализации рубцов, использование при необходимости сонографии, особенно в операционной, позволяют хирургу определить область, где он с наибольшей вероятностью обнаружит свободное пространство в брюшной полости для наложения пневмоперитонеума.
В процессе усовершенствования техники лапароскопии были предложены разнообразные пробы, контролирующие расположение иглы для нагнетания газа. В настоящее время чаще всего используют гидростатический тест. Канюля игл Вереша одноразового применения оснащена специальным Резервуаром для проведения этой пробы. К многоразовым иглам с этой целью присоединяют шприц без поршня, заполненный физиологическим раствором. Если конец иглы находится в свободной брюшной полости, жидкость Перетекает туда при поднятии брюшной стенки. Аналогичен механизм пробы "Застрявшей капли» (hanging drop test) — жидкость не уходит из канюли иглы, если она не проникла в брюшную полость или внедрилась в сальник, брыжейку кишки. Проведение этих проб предотвращает эмфизему брюшной стенки и внутренних органов. Аспирационный тест выполняется шприцем, соединенным с иглой Вереша, после введения через нее 5 - 8 мл физиологического раствора. В случае ранения сосуда в шприце появляются следы крови, при перфорации кишки — примесь кишечного содержимого. Этот тест позволяет избежать газовой эмболии, введения газа в просвет кишки [13]. На расположение конца мглы Вереша в свободной брюшной полости может указывать беспрепятственное смещение его в разные стороны [45]. Однако, у тучных больных с толстой брюшной стенкой этот признак выявить сложно. О проникновении иглы в брюшную полость можно судить по звуковым эффектам. После прокола брюшины раздается легкий щелчок сработавшего защитного механизма [39]. При интенсивном поднятии брюшной стенки, взятой двумя руками в складку, о достижении цели свидетельствует звук засасываемого через иглу воздуха (hiss test) [12]. Поднятие брюшной стенки руками или инструментами всегда создает более безопасные условия для пункции живота.
Если проникнуть в брюшную полость не удалось, предпринимают вторую попытку, проверив проходимость иглы и несколько изменив направление вкола. Повторная неудача у больных, имеющих послеоперационные рубцы на брюшной стенке, по мнению большинства авторов, является показанием к «открытой» лапароскопии, В случае высокой вероятности спаечного процесса некоторые хирурги предпочитают сразу начинать операцию по Hasson' у [13].
Перфорация кишки по данным аспирационной пробы требует выбора иной точки введения иглы, при этом берут другую, стерильную иглу. Изменяют точку вкола и при появлении следов крови в шприце. В таких случаях после введения лапароскопа в первую очередь тщательно ревизуют поврежденные образования. Травмированный сосуд коагулируют или клипируют. Забрюшинная гематома, как правило, возникает при ранении крупных сосудов и требует незамедлительной лапаротомии для наложения шва на стенку сосуда [51; 53). Если источник кровотечения не обнаружен — ревизуют рану брюшной стенки [13]. Поврежденную кишку обязательно осматривают еще раз перед завершением операции. Прокол кишки закрывают серозно-мышечным швом лишь при обнаружении выделений из него.
Судить о правильном расположении иглы Вереша позволяют также показатели датчиков лапарофлатора — давление в брюшной полости нарастает медленно и достигает заданной величины в 10 - 14 мм рт.ст. после введения не менее, чем 3 - 5 л СО2. Быстрое повышение давления при небольшом расходе газа указывает на то, что газ вводится не в брюшную полость. Чтобы избежать массивной эмфиземы в случае несоответствующего расположения иглы, газ начинают нагнетать с небольшой скоростью — 1л/ мин. В редких наблюдениях, вводимый в брюшную полость газ может скапливаться в изолированных спайками брюшинных карманах [38]. Быстрое повышение внутрибрюшного давления и асимметричное вздутие живота позволят предположить такую ситуацию. О равномерном распределении газа по брюшной полости свидетельствует быстрое исчезновение перкуторнои печеночной тупости.
Внимательное отношение к небольшим, казалось бы, деталям операционной техники помогает снизить риск осложнений на следующем этапе лапароскопического вмешательства — введении в брюшную полость 10 мм троакара для лапароскопии.
Ph.Mouret [45] утверждает, что можно составить представление о расположении висцеро-париетальных сращений, если после создания пневмопе-ритонеума движениями иглой Вереша вдоль задней поверхности брюшной стенки исследовать близлежащие отделы. Таким образом удается «нащупать дорогу» и отыскать свободное от спаек пространство для введения первого троакара. И.В.Федоров и соавт. [8], напротив, считает подобное действие
недопустимым из-за опасности повреждения внутренних органов и сосудов. На наш взгляд, осторожные, без какого-либо усилия движения иглой вреда не причинят, но они осуществимы лишь у пациентов с тонкой брюшной стенкой. При значительной толщине брюшной стенки такое исследование не только затруднено, но и, действительно, опасно.
B.Bateman и соавт, [12], проанализировав результаты лапароскопии у оперированных ранее больных, пришли к выводу, что если пневмоперитонеум накладывался иглой Вереша через околопупочный прокол, то безопасность последующей троакарной пункции обеспечивается введением троакара в этой же точке, в том же направлении, под тем же углом и на ту же или немного меньшую глубину, что вводилась игла. M.Meinero и соавт. [39] указывают на опасность вертикального направления вводимого «вслепую» троакара, которым можно повредить забрюшинные образования или прижимаемые к задней брюшной стенке органы. Троакар следует наклонить на 60 - 700 и направить в сторону от магистральных забрюшинных сосудов,
A.Yuzpe [62] обращает внимание на то, что хорошая заточка троакарного стилета является важным фактором безопасности лапароцентеза, поскольку облегчает введение инструмента и позволяет предупредить серьезные осложнения. S.Corson и соавт. [1В] также считают, что причиной ранений внутренних органов при троакарной пункции во многих случаях является чрезмерное усилие по преодолению сопротивления брюшной стенки. Проведенные ими измерения силы, необходимой для введения троакара в брюшную полость после наложения пневмоперитонеума, показали, что для одноразовых инструментов с защитным механизмом эта величина вдвое меньше, чем для многоразовых троакаров, которые профессионально затачиваются после каждых 16 операций. Следует отметить, что надсечение апоневроза в месте пункции также значительно уменьшает усилие на его преодоление и предотвращает «провал» в брюшную полость [39]. Разумеется, разрез кожи должен быть достаточным и не затруднять прохождение инструмента. Через установленный троакар незамедлительно вводится лапароскоп и в первую очередь осматриваются предлежащие органы для исключения их повреждения.
Чтобы избежать троакарного ранения внутренних органов у больных со спайками в брюшной полости G.Berci [13], A.Cuschieri [21] рекомендуют предварительно устанавливать 5 мм троакар в месте пункции иглой Вереша в левом подреберье и через него вводить соответствующий по диаметру лапароскоп. Визуальный выбор безопасного места введения 10-мм троакара, конечно, облегчает задачу, Однако, требует дополнительного инструментального оснащения, а 5-мм порт в левом подреберье для дальнейших инструментальных манипуляций неудобен и обычно не используется.
В начале 90-х годов Ph.Mouret [45] предполагал, что технический прогресс позволит создать телескоп, который можно будет ввести через иглу для наложения пневмоперитонеума, и с его помощью отыскать оптимальное место Для введения первого троакара. Предвидение сбылось. В 1995 г. D.Molloy [42] сообщил о практическом применении и диагностических возможностях нового оптического инструмента — микролапароскопа. Год спустя M.Gardner и G.Breton [25] опубликовали результаты апробации стекловолоконного «минископа» диаметром 1,7 мм, вводимого через иглу. Разрешающая способность прибора позволила выполнить с его помощью лапароскопическую холецистэктомию в эксперименте, а затем и в клинике.
G.Berci заявлял, что осложнения на первом этапе лапароскопической операции являются следствием недостаточного пневмоперитонеума или плохой техники. Газовая «подушка» увеличивает расстояние между брюшной стенкой и предлежащими органами. Даже приращенные к париетальной брюшине образования в силу тяжести провисают и отдаляются от нее, что делает троакарную пункцию живота менее опасной. Однако, в 1978 г. J.Dingfelder [221 опубликовал результаты лапароскопии, выполнявшейся без использования иглы Вереша — исследование начиналось с пункции живота троакаром, через который вводился газ. В последующие годы такая методика стала использоваться многими врачами не только при диагностических, но и оперативных вмешательствах. Судя по сообщениям, при прямом введении троакара осложнения возникают не чаще, а то и реже, чем в случаях предварительного наложения пневмоперитонеума. Мотивировка такой последовательности действий, в изложении F.Nezhat с соавт. [47], сводится к следующему. Когда лапароскопию начинают с пункции иглой Вереша, то три этапа выполняются вслепую: введение иглы, нагнетание газа через иглу, введение троакара. При прямой троакарной пункции число манипуляций, выполняемых вслепую, уменьшается до одной. Визуальный контроль расположения троакара до начала инсуффляции СО; уменьшает частоту подкожных и сальниковых эмфизем. Если происходит случайная пункция кишки, то удается избежать пневмоинтестикума, а при повреждении сосуда — газовой эмболии. Однако, те же авторы при сравнительном анализе прямого и традиционного способов введения троакара исключили из исследования пациентов с лапаротомиями в анамнезе. Объяснение этому находим в сделанных ими же выводах, что «иглу Вереша следует применять, когда прямое введение троакара не принесет пользы». C.Copeland с соавт. [17] более ясно и однозначно оговаривают, что техника прямой троакарной пункции может быть использована лишь у пациентов без предшествовавшей лапаротомии. S.Kaali и D.Barad [34] было показано, что серьезных осложнений прямой троакарной пункции вследствие адгезивного процесса можно было бы избежать, воспользовавшись традиционной методикой пневмоперитонеума.
Среди 679 наших пациентов с лапаротомиями в анамнезе у 20 отмечены компликации при использовании иглы для пневмоперитонеума. Осложнения в результате прокола иглой обычно представляли собой эмфизему различных клетчаточных пространств и она не создавала реальной угрозы для здоровья пациентов. При наличии спаек эмфизема возникала вдвое чаще, чем в их отсутствие. Прокол иглой подпаянных к брюшной стенке кишок каких-либо негативных последствий не повлек. В отличие от этого повреждения вследствие троакарных проколов, случившиеся у 5 больных, потребовали конверсии или лапаротомного завершения операции. Поводом к лапаротомии трижды явились ранения тонкой кишки и дважды — сосудов большого сальника. Во всех случаях повреждения были спровоцированы сращениями с брюшной стенкой. Троакарная перфорация кишки произошла лишь у больных, которым не был предварительно создан пневмоперитонеум, что является значимым фактом. Наложение пневмоперитонеума уменьшает опасность троакарной пункции не только защитной газовой «подушкой» между брюшной стенкой и внутренними органами. Защитить плотно припаянную к брюшине кишку газ не сможет. Нам представляется, что в подобных случаях главную защитную функцию выполняет не газовая прослойка, а сама попытка применения иглы Вереша. Она оказалась весьма чувствительным индикатором висцеро-париетальных сращений. Так, среди 2б больных, имевших спайки в месте прокола иглой, пункция не удалась у 21 (80,8%). При этом никаких осложнений кроме эмфиземы, отмеченной в ряде случаев, не возникло.
При тех же обстоятельствах у 5 (19,2%) больных был получен ложноотрицательный результат, когда проколов сальник иглой и не почувствовав этого, создали пневмоперитонеум. Иллюзия беспрепятственности для последующей троакарной пункции таит определенную опасность. Решая, в чем же она состоит, мы рассуждали следующим образом. Ввести газ в брюшную полость с помощью иглы в случае предлежания фиксированной спайками кишки можно, лишь проколов ее насквозь. В отличие от прокола сальника это потребует существенного усилия и абсолютного пренебрежения к проведению водных проб. Мы такими наблюдениями не располагаем и сообщений в печати о подобных случаях не встречали. Поэтому можно считать, что введение троакара после успешного создания пневмоперитонеума потенциально опасно лишь ранением сосудов подпаянного сальника. Троакарные ранения сосудов сальника и брюшной стенки у наших пациентов произошли при пункции инструментом с пирамидальной заточкой стилета. Острые грани его предназначены для рассечения плотного апоневротического слоя. Но это несложно сделать остроконечным скальпелем, после чего можно применить стилет конической формы, лишенный режущего эффекта. Использовать такой троакар без предварительного рассечения апоневроза не следует, поскольку введение его требует большего усилия, нередко сопровождается внезапным «провалом» и грозит повреждением глубоко расположенных образований.
Рассматривая пункцию иглой Вереща как тест на наличие висцеро-париетальных сращений, следует учесть, что в 1,5% всех случаев использования иглы он оказался ложноположительным — при отсутствии спаек ввести газ в полость брюшины не удалось. Такие неудачи случались у начинающих операторов.
Больным с лапаротомиями в анамнезе некоторые хирурги накладывают пневмоперитонеум через прокол В левой половине живота, но первый троакар вводят в параумбиликальной зоне. Конечно, введение троакара при наличии газовой «подушки» представляет меньшую опасность. Но такая методика делает троакар «первопроходцем» и исключает диагностическое значение пункции иглой Вереша.
Установка первого троакара в левой половине живота всегда позволяет использовать его в последующем в качестве манипуляционного порта при лапароскопической аппендэктомии, герниопластике, гинекологических операциях. Но для ЛХЭ такое расположение инструмента неудобно. Наиболее комфортные условия для оперирования в подпеченочном пространстве создает визуальный контроль из параумбиликальной точки. Поэтому лапароскоп приходится переставлять во вводимый там троакар.
10-мм прокол брюшной стенки слева, призванный обезопасить введение Центрального троакара, увеличивает травматичность вмешательства примерно в той же степени, что и минилапаротомный разрез возле пупка, но риод «слепой» пункции в любом месте все же выше, чем у методики Hasson'a. Этим объясняется то, что у больных, перенесших перитонит, операции на кишке, а также любые другие длительные или травматичные вмешательства брюшной полости, большинство хирургов предпочитает «открытую» лапароскопию по Hasson-y или ее модификации, производя разрез в непосредственной близости, а иногда и по ходу послеоперационного рубца. Несмотря на неудобство такой техники, проникновение в полость брюшины под визуальным и мануальным контролем делает ее логическим методом выбора у пациентов с высокой вероятностью спаечного процесса, «неудачным» расположением рубцов на брюшной стенке.
По нашим данным минилапаротомия в параумбиликальной зоне после неудавшейся пункции иглой Вереша сопровождалась разделением спаек для введения троакара в 85,7% случаев. Но при операциях, сразу же начинавшихся с введения троакара по Hasson'у, разделять сращения потребовалось лишь 17,1% больных. Реже всего к этому прибегали после неосложненной аппендэктомии и гинекологических вмешательств. Осторожность и перестраховка хирурга выбором «открытого» способа введения троакара вреда больным не причинили, но и необходимости в нем, как свидетельствует анализ, в подавляющем большинстве случаев не было.
При введении троакара в параумбиликальной зоне для выполнения ЛХЭ несомненным показанием к использованию методики Hasson'а являются перенесенные в прошлом хирургические вмешательства верхнесрединным или верхне-среднесрединным лапаротомным доступом, операции на толстой кишке, операции по поводу пупочной грыжи или грыжи белой линии живота, многократные лапаротомии, анамнестические указания на перитонит любой этиологии, а также наличие пупочной или параумбиликальной грыжи, которую можно устранить симультанно. В последнем случае используют герниолапароскопический доступ [5]. Методика состоит во введении лапароскопа через пупочные или околопупочные грыжевые ворота после вскрытия грыжевого мешка, освобождения от спаек и вправления в брюшную полость грыжевого содержимого. На грыжевые ворота накладывается кисетный шов, затягиваемый после введения троакара.
После неосложненной аппендэктомии и гинекологических операций лапароскопическое вмешательство без особого риска может быть начато с пункции иглой Вереша в параумбиликальной зоне. Если предшествующая гинекологическая операция выполнялась из нижнесрединного разреза, пункцию иглой следует производить над пупком. Малейшие сомнения в достоверности гидростатического теста или других водных проб требуют «открытого» введения троакара,чтобы избежать образования сальниковой или иной эмфиземы.
При выполнении лапароскопических операций на органах нижнего «этажа» брюшной полости, в частности аппендэктомии и герниопластики, альтернативой «открытому» введению троакара в параумбиликальной зоне является создание пневмоперитонеума иглой Вереша через прокол в мезогастрии слева или левой подвздошной области с последующим введением первого троакара в точке пункции иглой. Такая тактика может быть избрана у больных, перенесших ранее холецистэктомию, резекцию желудка и другие вмешательства в верхних отделах живота, а также гинекологические операции.
Возможность микролапаротомии оказывается проблематичной при выраженном ожирении. Разрез приходится значительно удлинять, травматичность операции и вероятность раневых осложнений при этом возрастают. К недостаткам «открытого» способа введения троакара следует отнести ненадежность герметизации брюшной полости, каким бы способом она не производилась — ушиванием или обтурацией минилапаротомной раны специальной канюлей. Утечка газа требует усиления подачи СО2. Послойное зашивание раны затруднительно у тучных пациентов, а временное наложение лишь кожных герметизирующих швов способствует развитию предбрюшинной и подкожной эмфиземы.
Альтернативой «открытой» лапароскопии в последние годы становится визуально сопровождаемое введение первого троакара. Для этого созданы специальные троакары, имеющие прозрачный тупой наконечник с сепаратором для разъединения тканей под прямым визуальным контролем («Endopath Optiview» — Ethicon Endosurgery; «Visiport» — Autosuture). Эти инструменты позволяют различать тканевые структуры. Визуально определяется также наличие сращений с париетальной брюшиной, которые можно тупо разъединить или уклониться от контакта с ними. Таким образом, вероятность повреждения сосудов и кишки уменьшается [35; 36]. Р. Reissman и S. Wexner [49] считают, что если начально выбранное место пункции занято сращениями, то апоневроз следует зашить и избрать другую точку. Однако, количество публикаций, оценивающих эффективность и надежность видеотроакарного доступа, пока невелико и явно недостаточно для убедительных выводов.
Наш опыт применения оптического троакара при операциях на органах верхней и нижней половины брюшной полости свидетельствует, что он позволяет отчетливо различить жировую, апоневротическую и мышечную ткань брюшной стенки. Удается увидеть венозные сосуды в толще жировой клетчатки и уклониться от травмирующего контакта с ними. Однако, распознать листок париетальной брюшины без предварительного введения газа в брюшную полость оказалось весьма сложно. Просвечивающий через брюшину предлежащий сальник воспринимается как слой предбрюшинной клетчатки. Отыскать границу жирового предбрюшинного слоя было труднее всего у больных с ожирением. Оставалось сомнение — не вышел ли троакар за пределы брюшной стенки и не проник ли в толщу подпаянного сальника. Распознать спайки большого сальника с париетальной брюшиной на фоне пневмоперитонеума легко удавалось в тех случаях, когда оптическая полусфера троакара оказывалась вблизи границы сращения. Об опасности переоценки возможностей визуального сопровождения троакарной пункции свидетельствует следующее клиническое наблюдение.
Больная М., 76 лет (история болезни 10204), страдающая ожирением П ст., госпитализирована в плановом порядке для оперативного лечения хронического калькулезного холецистита. 10 лет назад была оперирована по поводу пупочной грыжи, произведена пластика апоневроза по Сапежко. На брюшной стенке рубец длиной 10 см по средней линии живота, огибающий пупок слева.
Через кожный разрез в правой нижней точке Калька введен троакар «Visiport», с помощью которого малыми порциями поэтапно рассечены все слои брюшной стенки, лапароскоп введен в брюшную полость и наложен пневмоперитонеум. Висцеро-париетальные спайки, располагавшиеся преимущественно в левой половине живота, выполнению лапароскопической холецистэктомии не препятствовали. Удаленный желчный пузырь извлечен через эпигастральную рану с помощью 18-мм троакара. Продолжительность операции 40 мин. Дренаж из подпеченочного пространства удален на следующий день утром.
В ближайшие 2 суток после операции сохранялась субфебрильная температура, больная отмечала умеренные боли в параумбиликальной зоне, Однако, состояние ее расценивалось как удовлетворительное. На 3-и сутки боли усилились, появились припухлость и легкая гиперемия кожи в окружности троакарнаго прокола в точке Калька, стал выявляться симптом Щеткина-Блюмберга в правой верхней части живота. При ревизии раны получено мутное отделяемое, окрашенное желчью. Заподозрен желчный перитонит вследствие несостоятельности культи протока.
Произведена верхнесрединная лапаротомия. В брюшной полости около 300 мл выпота с хлопьями фибрина без примеси желчи. В параумбиликальной зоне плотными сращениями фиксированы большой сальник и кишка. Спайки разделены, после чего обнажился участок тонкой пересеченный на 1/3 окружностпи. Поврежденная петля тощей кишки в 1 м от трейцевой связки выделена из сращений и резецирована с анастомозом «бок в бок». Пункционный троакарный раневой канал с некротизированными тканями по краям иссечен, образовавшаяся рана дренирована. Брюшная полость санирована и зашита.
Лапаротомная рана зажила первичным натяжением. Выписана стационара через 10 дней после повторной операции.
Приведенное наблюдение свидетельствует не только о ки видеотроакарной пункции брюшной полости, но и о том, технические новшества не исключают устоявшихся тактических принципов – пункцию брюшной плости не следует производить вблизи от послеоперационных рубцов. Помимо этого, здесь была допущена еще одна ошибка — место первичной троакарной пункции не было эпигастрального прокола. Увидев, что троакар проник сквозь конгломерат, можно было бы заподозрить возникшее осложнение, своевременно выявить и устранить его.
Этот клинический пример интересен также тем, что проникающее троакарное ранение кишки отчетливо проявилось через, жуток времени. Вероятно, абсцесс, формировавшийся в окружности поврежденной кишки, до поры был отграничен от брюшной полости брюшной стенке сальником.
Лапароскопическая ревизия брюшной полости определяет план дальнейших действий первый манипуляционный трокар устанавливают там, где нет висцеро-париетальных сращений. Через него освобождают от спаек брюшную стенку в местах предстоящего введения остальных Обширные сращения, не позволяющие увидеть ни одну из намеченных точек введения манипуляторов, вынуждают к установке троакара в любом ином месте, доступном осмотру через лапароскоп. Главное, чтобы это находилось на достаточном удалении от зоны сращений, которые разъединить. Слишком близкое расположение троакара значительно затрудняет работу, удлиняет время операции и делает сам лизиса более опасным.
В такой ситуации троакар приходится сильно наклонять, чуть прижимая его к брюшной стенке снаружи. Чем толще брюшная стенка, тем большего усилия это требует. Не говоря уже о возрастающем инструментов, чрезмерная боковая нагрузка на манипулятор скрадывает тонкие тактильные ощущения сопротивления тканей и затрудняет точную дозировку усилия, необходимого для безопасного расслоения их. К тому же, близко введенный троакар приходится максимально оттягивать кнаружи, оставляя в брюшной полости лишь самый дистальный отдел его длинной буквально в несколько миллиметров. В результате из-за тугого движения манипуляторов, изгибающихся по оси, троакар часто выходит из полости и его приходится вводить заново.
Обширные висцеро-париетальные сращения иногда не, возможности для выбора точки введения манипулятора, соответствующей предъявляемым требованиям. Возникающие в таких случаях неудобства мы стараемся смягчить и используем для этого следующие приёмы. При вынужденном введении манипуляционного троакара вблизи от места Предстоящего рассечения спаек брюшную стенку пунктируем под таким углом, чтобы максимально уменьшить усилие, которое потребуется затем для отклонения троакара. Создаваемый таким образом пункционный канал имеет косое направление и несколько большую протяженность в толще брюшной стенки. Предварительно надетый на каиюлю троакара фиксатор ввинчивается в пункционный канал и надёжно закрепляет троакар на минимальной глубине, препятствуя его смещению (Рис.80).
Заслуживает внимания пропагандируемое В. Salky [50] предложение использовать при адгезиолизисе лишь 10-мм троакары, что позволяет менять расположение лапароскопа и манипуляторов. Осмотр зоны сращений в разных ракурсах создает более полное представление о характере, локализации и протяженности спаек, о вовлеченных в них органах, а инструментальный доступ к спайкам с нескольких сторон упрощает их разделение и делает процесс более безопасным. В технически трудных случаях адгезиолизиса мы использовали для этих целей дополнительные 10-мм троакары, устанавливая один или два из них в атипичных точках.
Так, например, мы поступили при выполнении операции ЛХЭ у больного К.,52 лет (история болезни 1193), перенесшего 11 лет назад резекцию 2/3 желудка по поводу язвенной болезни и имевшего обширные брюшинные сращения в мезогастральной, эпигастралъной и правой подреберной областях. После, того, как через минилапаротомный разрез в околопупочной области троакар с лапароскопом удалось провести сквозь сращения в мезогастралъную область слева, там был установлен второй 10-мм троакар. Под контролем введенного через него лапароскопа установлен 5-мм троакар в левом подреберье (Puc.Sla). Разделение спаек начато с эпигастралъной зоны, где вскоре обнаружились плотные сращения культи желудка с брюшной стенкой. Тогда 5-мм троакар заменили на 10-мм,
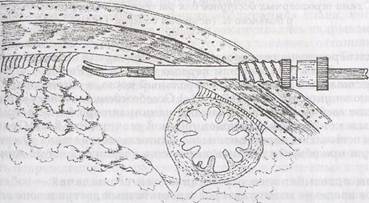 Рис.80. Способ установки манипуляционного трокара при вынужденно близком расположении его от места предстоящего рассечения спаек
Рис.80. Способ установки манипуляционного трокара при вынужденно близком расположении его от места предстоящего рассечения спаек
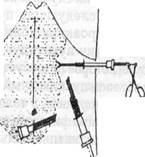
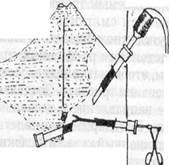
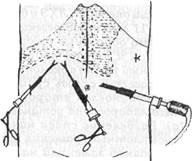
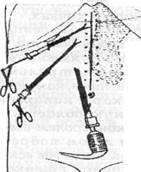
Рис. 81. Схема троакарных доступов для рассечения спаек при выполнении ЛХЭ у больного К. (история болезни 1193)
лапароскоп переставили в правое подреберье. Доступом из мезогастрия слева разделили спайки в окружностпи первого троакара (Рис.81б). Лапароскоп вновь переставили в левый мезогастральный порт, а адгезиолизис продол- жили из околопупочной точки (Рис.81в). Освобождение от спаек «стандартп- ного» места введения эпигастрального манипулятора было завершено под визуальным контролем из околопупочной точки (Рис.81г). Сращения с желудком оставлены неразделенными. Длительность этапа адгезиолизиса — 50 минут при общей продолжительности операции 1 час 35 минут.
Объем адгезиолизиса ограничивается его задачей — обеспечить безопасное введение манипуляторов и достаточный доступ к зоне оперативного вмешательства. Но в некоторых случаях действия на этом этапе приходится расширять, устраняя все те спайки, вокруг которых может произойти заворот кишки.
Разъединение сращений производят как «тупыми», так и «острыми» способами, обычно сочетая и попеременно используя их. Тупое разделение выполняют, расслаивая ткани тупфером, диссектором или иным инструментом, струей жидкости под давлением (гидродиссекция), либо отрывают спайки натяжением. Для рассечения применяют ножницы, высокочастотную диатермию в моно- или биполярном режиме, лазер, ультразвук.
Преимуществом «тупого» разделения сращений является минимальная вероятность механического повреждения крупных сосудов и полых органов, сращенных с париетальной брюшиной. Однако, при сформировавшихся плотных спайках такой способ малоэффективен. Расслоение диссектором производится лишь малыми порциями, медленно, а плотные ткани ему вовсе не поддаются, «Обдирание» спаек с помощью зажима происходит значительно быстрее, но процедура эта более травматична, сопровождается кровотечением из мелких разорванных сосудов спаек и может привести к формированию гематом. Разорвать плотные ткани таким способом не удается.
При «тупом» способе разделения брюшинных сращений важными техническими аспектами являются усилие и направление тяги. Умение правильно дозировать усилие приходит, конечно, не сразу. Приобретая такой навык, лучше избегать резких и грубых движений инструментом, захвата больших порций тканей для «тупого» разделения. Замедленные движения, постепенно увеличиваемое натяжение, разделение тканей малыми порциями позволяют точнее оценить податливость тканей и лучше ощутить тот порог натяжения, который не следует переступать.
Разделять спайки следует по плоскости сращения с париетальной брюшиной, оттягивая их внутрь. Это позволяет отдалиться от подпаянного органа на более безопасное расстояние, лучше рассмотреть спайку и проходящие в ней сосуды, обнаружить прикрытые сальником органы, что уменьшает вероятность их повреждения.
Сращения кишки с брюшной стенкой создают наибольшие сложности при адгезиолизисе. «Тупое» разделение спаек тракцией за кишку мы считаем недопустимым. Опасно и растяжение их диссектором вдоль кишечной стенки, при этом возникали субсерозные гематомы или надрывы серозной оболочки. Мы убедились, что разъединять кишечные сращения «тупым» способом не стоит, если только это не свежие, рыхлые спайки,
Совершенно неприемлема техника «обдирания» спаек, когда в них вовлечена капсула печени. Такие попытки заканчивались надрывом капсулы и паренхиматозным кровотечением, которое удавалось остановить лишь созданием ожогового струпа на поврежденном участке печени. В этих случаях Применение ножниц или электрохирургического крючка наименее опасно.
Для устранения спаек «острым» путем наиболее удобным инструментом являются изогнутые ножницы с закругленными браншами (ножницы Метценбаума) и ротационным механизмом, имеющие электроизоляционное Покрытие и обеспечивающие при необходимости электрокоагуляцию тканей. Однако, при разделении спаек ножницами в направлении «от себя» под острым углом контролировать глубину рассечения бывает сложно, при этом возникает опасность повреждения сосудов и тканей органов, вовлеченных в сращения и не видимых в толще спаек. Чтобы каждую порцию тканей, взятую на бранши, можно было осмотреть, прежде чем рассечь, ножницы нужно расположить под углом не менее 600 к оси зрения лапароскопа, что требует соответствующего расположения манипуляционного троакара. На практике проще корригировать угол зрения использованием лапароскопа с угловой оптикой.
С его помощью удается выбрать оптимальный ракурс, не меняя расположения троакара.
Наименее васкуляризированные участки спаек — это места их прикрепления. Именно поэтому разделять их следует по плоскости сращения. При висцеро-париетальных сращениях движения инструмента направляют строго вдоль париетальной брюшины.
Обильно васкуляризированные спайки после рассечения могут интенсивно кровоточить, поэтому их приходится предварительно коагулировать Гемостаз на участках уже рассеченных тканей удобнее и безопаснее производить зажимом с узкими браншами или диссектором с изолирующим покрытием. Кровоточащие сосуды избирательно захватывают зажимом отводят от окружающих тканей и коагулируют по отдельности.
Применение высокочастотной электрокоагуляции и электротомии при устранении исключительно сальниковых сращений реальной угрозы термических повреждений внутренних органов не создает при правильном выборе режима работы электрохирургического аппарата.
Общепризнано, что сложнее и опаснее всего разделять плотные плоскостные сращения с вовлечением кишки. Наиболее рискованно использовать для этого лазер [43]. Не менее опасна моноактивная диатермия [58; 59j. J.Amaral с соавт. [10] в эксперименте на свиньях разными способами пересекали сосуды и гистологически по коагуляции белка оценивали распространенность ожога, сопоставляя изменения, возникавшие тотчас и спустя 4 дня после операции. Если при разрезе ультразвуковым скальпелем глубина некроза составила соответственно 1,9 и 2,0 мм, при биполярной диатермии — 4,7 и 5,7 мм, то при монополярной — 5,2 и 8,8 мм. Поэтому большинство хирургов старается рассекать кишечные спайки ножницами, а где возможно — расслаивать их. Мы многократно наблюдали диффузное капиллярное кровотечение из спаек на кишечной стенке, когда кишка мобилизовалась «острым» способом, но коагуляцию не применяли. Во всех случаях гемостаз произошел естественным образом спустя 4-6 минут. После этого оставалось лишь собрать и удалить отсосом небольшие сгустки крови.
Для взвешенного представления о современных возможностях эндовидеохирургической техники нельзя не учитывать и негативного отношения некоторых авторов [49] к выделению кишечной петли из плотных сращений. В таких случаях они считают лапароскопическую методику неоправданной, так как слишком велик риск энтеротомии и отдают предпочтение более безопасной лапаротомии.
Важным условием успешного адгезиолизиса является достаточное натяжение спайки, позволяющее осмотреть ее на всем протяжении, выяснить анатомические соотношения и определить наименее васкуляризированные области, которые будут разделены в первую очередь. Если для натяжения спайки или отведения кишки необходим дополнительный инструмент — его следует ввести. Как считает B.Salky [50], тракция и контртракция должны выполняться лишь оператором, а не ассистентом, что возможно при работе двумя руками. Натяжению спаек под тяжестью органов иногда способствует соответствующий наклон операционного стола. Такой прием уменьшает травматизацию кишки отводящими ее инструментами. Кровеносные сосуды в спайке должны быть коагулированы или клипированы до их рассечения-Однако, с сосудами большого сальника, фиксированного к брюшной стенке, в контакт вступать не надо. Разделение сальниковых сращений начинают с бессосудистых участков, обходя подпаянный к брюшной стенке сосуд с разных сторон. По мере уменьшения площади оставшегося сращения спайка в области сосуда сильнее растягивается, он отдаляется от брюшной стенки, становится отчетливо видимой граница между сосудом и париетальной брюшиной. В некоторых случаях участок большого сальника с крупными сосудистыми стволами, плотно сращенными с брюшной стенкой может быть мобилизован отсечением вместе с париетальным листком брюшины по ходу сосуда.
Электрохирургические манипуляции при адгезиолизисе треоуют строго соблюдения принципов безопасного использования высокочастотной диатермии. Избирают режим коагуляции с минимально необходимой мощностью, энергию подают короткими разрядами с небольшими временными интервалами, предпочтение отдают биполярной коагуляции, не допускают использования инструментов с нагаром на рабочей поверхности, коагуляцию производят в максимально удаленном от кишки месте. Использование ультразвуковой коагуляции и диссекции в широкой практике распространения пока не получило из-за дороговизны прибора и соответствующих инструментов.
Наряду с моно- и биполярной коагуляцией иногда применяют лигирование внутриспаечных сосудов, стараясь уменьшить риск термического повреждения кишки, после чего рассекают сращения ножницами [46]. При обширном адгезиолизисе рекомендуют в завершении операции вводить и оставлять в брюшной полости 500 мл раствора Рингер-лактата и сразу после операции начать медикаментозную стимуляцию желудочно-кишечной перистальтики для профилактики интенсивного спайкообразования, назначают антибиотики в течении двух суток.
При выполнении ЛХЭ нам приходилось сталкиваться с обширными висцеро-париетальными сращениями, полностью захватывавшими 1 - 2 квадранта живота. Их не расценивали как противопоказание к применению лапароскопической технологии и ни у одного из больных они не явились поводом для конверсии. Всем больным удалось разъединить брюшинные спайки и произвести ЛХЭ. Единственное осложнение, возникшее при адгезиолизисе и потребовавшее лапаротомного устранения его — надрывы серозно-мышечной оболочки двенадцатиперстной кишки — произошло при попытках тупого выделения кишки из сращений. Это осложнение составило 1,5% от всех случаев адгезиолизиса и 0,2% среди всех больных, которым ЛХЭ выполнена после ранее перенесенных операций на брюшной полости.
В ряде наблюдений этап адгезиолизиса продолжался более 1 часа и превышал продолжительность основного этапа операции. Много времени затрачивалось на устранение обширных по площади спаек, на разделение Плотных сращений кишки с брюшной стенкой, когда приходилось действовать сверхосторожно. Но в большинстве случаев причиной длительно продолжавшегося адгезиолизиса были технические неудобства — плохой обзор, невыгодное расположение троакаров, затрудненный доступ к спайкам. Малоэффективные и небезопасные манипуляции при указанных обстоятельствах, в конечном счете, вынуждали хирурга изменить расположение одного из Троакаров или ввести дополнительный, после чего действия значительно ускорялись. Ретроспективный анализ таких операций свидетельствует, что технические сложности при рассечении спаек в значительной мере уменьшаются созданием комфортных условий для хирургических манипуляций. Время, затраченное на перестановку или замену троакаров, укрепление их фиксаторами, введение дополнительных инструментов, наклон операционного стола и прочие приготовления, окупается последующей экономией времени за счет более уверенных и быстрых действий, а также снижением риска операции.
В некоторых публикациях подчеркивалось, что при лапароскопических вмешательствах рассечение спаек должно производиться в объеме, минимально необходимом для выполнения намеченной операции. Придерживаясь того же взгляда, мы не раз были вынуждены возвращаться к более широкому рассечению спаек, прервав действия на основном этапе операции. Исходно недостаточное устранение сращений ограничивало и затрудняло движения инструментами, а поэтапное рассечение спаек, требующее перестановки и смены инструментов, удлиняло операцию. Поэтому мы считаем, что рассечение послеоперационных спаек при лапароскопическом вмешательстве желательно производить одномоментно в объеме, необходимом для безопасного и удобного выполнения намеченной операции, а также адекватного завершения ее. Симультанный (расширенный) адгезиолизис может быть оправдан необходимостью устранения спаек, угрожающих странгуляцией кишки, или веско обоснованными диагностическими или лечебными целями.
У больных со спайками в брюшной полости лапароскопическую операцию следует начинать с осмотра и инструментальной ревизии патологического очага, когда он доступен. К устранению спаек приступают, если лапароскопическая операция представляется выполнимой. Такая тактика позволяет в определенных ситуациях воздержаться от излишних хирургических действий.
Активная разработка эндовидеохирургической техники адгезиолизиса привела к тому, что в настоящее время рассечение брюшинных сращений при лапароскопических операциях становится обычным явлением и достаточно эффективно выполняется даже в тех случаях, когда основанием для этого является спаечная кишечная непроходимость [24; 32; 44; 46; 49]. Поскольку рассечение сращений обычно обеспечивает достаточный доступ и позволяет выполнить запланированную лапароскопическую операцию, была подвергнута сомнению правомочность рассмотрения предшествовавших операций на органах живота в качестве относительного противопоказания к использованию новой технологии [40; 60; 61].
К сожалению, выводы о безопасности вмешательств в таких ситуациях, основанные лишь на нескольких десятках удачных операций, оказались слишком оптимистичными. Schirmer с соавт. [51] проанализировали результаты л а па рос конической холецистэктомии, выполненной у 541 больного с абдоминальными вмешательствами в анамнезе. Оказалось, что если предшествовавшие операции предпринимались по поводу патологии нижнего «этажа» брюшной полости, то это, действительно, не сказывалось на результатах лапароскопической холецистэктомии в сравнении с контрольной группой больных ни по длительности операции и способу ее завершения, ни по количеству осложнений и длительности госпитализации, кроме более частых осложнений раневой инфекцией. Однако, после операций на верхнем «этаже» брюшной полости лапароскопической холецистэктомии чаще сопутствовали интраоперационные, послеоперационные и общие осложнения, пациенты значительно дольше находились в стационаре и обращались туда повторно после выписки, отмечены летальные исходы. Частота раневых нагноений в исследуемых группах ассоциировала с более частым использованием доступа по Hasson'y.
Несомненно, перенесенные ранее заболевания и операции в нижней половине брюшной полости могут аналогичным образом затруднить выполнение и ухудшить послеоперационные результаты лапароскопической герниопластики, гинекологических операций.
В настоящее время продолжает дискутироваться ряд вопросов, затрагивающих интересы рассматриваемого нами контингента больных. Оправданы ли лапароскопические операции при наличии обширных брюшинных сращений? Не слишком ли они опасны для больных? Не проще ли и надежнее в таких случаях выполнить операцию традиционным способом? Конечно, однозначных ответов на эти вопросы быть не может. При чрезвычайном разнообразии клинических ситуаций разговор идет лишь о выработке и принятии оптимального плана действий для конкретного случая. При этом необходимо учитывать множество разнообразных факторов.
Прежде всего, следует ответить на вопросы — сможет ли больной перенести лапароскопическую операцию по своему общему статусу, нет ли общих противопоказаний для создания напряженного пневмоперитонеума, не являются ли характер, стадия основного заболевания и развившиеся осложнения противопоказанием к применению эндовидеохирургической технологии, какие анатомические последствия предшествовавших операций наиболее вероятны.
Как показали исследования, большая часть больных, перенесших ранее какие-либо операции традиционным способом, брюшинных спаек не имела, а среди тех, у кого сращения возникли, выполнению операции они не воспрепятствовали. Так что отказ от использования лапароскопической технологии на том лишь основании, что у больного могут быть спайки после предшествующей операции совершенно необоснован. Висцеро-париетальные сращения могут быть выявлены до операции с помощью ультразвуковой эхолокации, но нельзя сказать априорно, что они потребуют лапароскопического адгезиолизиса или что адгезиолизис будет слишком опасен. Такую информацию можно получить только при лапароскопии.
Следует исходить из того, что препятствия, создаваемые брюшинными сращениями после ранее перенесенных лапаротомий, в принципе, технически преодолимы. Но для этого в распоряжении хирурга должны быть высококачественная аппаратура и соответствующие инструменты, квалифицированные помощники. Необходимым условием является должный уровень анестезиологического обеспечения и, конечно, подготовленность и личный опыт оператора в проведении эндовидсохирургических операций. Дефицит этих факторов является разумным основанием для отказа от лапароскопического адгезиолизиса по техническим, организационным или иным мотивам, но не противопоказанием по безнадежности анатомической ситуации.
Потенциальная опасность адгезиолизиса состоит еще в том, что вероятность нехирургических осложнений (гемодинамические нарушения, дыхательные расстройства и проч.) возрастает по мере увеличения продолжительности лапароскопической операции, особенно у пожилых и старых людей. Определить ту черту, за которую не следует переступать в стремлении устранить спайки лапароскопически, весьма сложно. Безопасный временной предел индивидуален. Мы считаем, что одним из основных критериев в решении дилеммы — продолжение лапароскопического адгезиолизиса или конверсия — должна быть динамика процесса. При операциях у наших пациентов затрачивалось не более 5 мин. на то, чтобы составить представление о характере брюшинных сращений и возможности их устранения. Поэтому отсутствие явных позитивных сдвигов при разделении спаек в течение 5—10 мин. может служить доводом в пользу конверсии. В то же время медленные, но успешные действия на этом этапе дают больному шанс избежать негативных последствий лапаротомии. По нашим наблюдениям увеличение продолжительности ЛХЭ за счет, адгезиолизиса на 30 - 60 мин. на самочувствии и состоянии больных после операции не отразилось.
К лапароскопическому рассечению обширных брюшинных спаек при лапароскопической аппендэктомии мы относимся сдержанно. Переход к традиционному способу аппендэктомии не столь травматичен, как при холецистэктомии, К тому же лапаротомным путем операция обычно выполняется быстрее и послеоперационное лечение не столь уж длительно. Однако некоторые наблюдения свидетельствуют о несомненных преимуществах лапароскопического способа разделения спаек при аппендэктомии, например когда это требуется для качественной санации брюшной полости при перитоните.
Целесообразность рассечения обширных спаек, в том числе с кишкой., не вызывает сомнений, когда речь идет о лапароскопической герниопластике с целью устранения рецидивных паховых грыж, при которых такой способ лечения наиболее эффективен. Небольшие, впервые возникшие грыжи безопаснее устранить традиционным оперативным способом, чем высвобождать кишку из сращений с брюшной стенкой для лапароскопической герниопластики.
Таким образом, у больных с послеоперационными брюшинными сращениями окончательное решение об оперативной технологии холецистэктомии, аппендэктомии, герниопластики и других вмешательств следует принимать на основании результатов лапароскопической ревизии и пробного адгезиолизиса. Предпочтение традиционному способу операции должно быть отдано в тех случаях, когда риск лапароскопического адгезиолизиса превышает риск негативных последствий лапаротомии.
Перенесенные больными в прошлом хирургические вмешательства в брюшной полости ставят их в особое положение и позволяют вполне обоснованно отнести эту категорию людей к группе повышенного риска при лапароскопическом способе оперативного лечения. Предлагаемые для таких больных приемы профилактики интраоперационных осложнений многообразны, но ни один из них не гарантирует полной безопасности.
 2015-05-12
2015-05-12 2427
2427
