В теоретическом приложении к лабораторной работе №5 было указано, что скорости ферментативных реакций рассчитывают либо по убыли исходных веществ т.е. субстратов, подвергающихся каталитическому воздействию, либо по образованию и накоплению продуктов реакции в единицу времени. Одним из примеров реакций, часто используемых в лабораторных практикумах для определения кинетических параметров, является реакция гидролиза крахмала под действием амилазы слюны. Следует, однако, помнить, что корректное определение главных кинетических параметров ферментативных реакций – константы Михаэлиса, К m, и максимальной скорости, V max, возможно лишь в условиях начальной стадии процесса, когда концентрация субстрата велика и практически соответствует его исходному количеству, фермент находится в состоянии насыщения и, следовательно, скорость реакции пропорциональна концентрации фермент-субстратного комплекса [ES]. Вполне понятно, что при высокой концентрации субстрата, как это имеет место в случае гидролиза крахмала, следить за начальной скоростью реакции по его убыли затруднительно. Поэтому наиболее грамотно определять начальную скорость процесса не по убыли субстрата, а по накоплению продукта реакции.
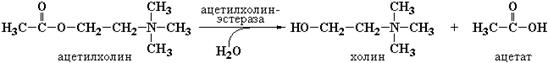 |
Исходя из сказанного выше, удобной системой для расчета К m и V max в условия in vitro может быть ацетилхолинэстераза (АХЭ) мембран теней эритроцитов, которая катализирует реакцию гидролиза сложноэфирной связи в ацетилхолине (АХ) с образованием холина и ацетата:
В ферментативной кинетике успех определения кинетических параметров зависит не только от выбранной ферментной системы, но и от чувствительности и адекватности метода анализа продукта или продуктов реакции. В нашем случае в качестве субстрата ацетилхолинэстеразы целесообразно использовать не ацетилхолин, а его аналог – ацетилтиохолин (АТХ):
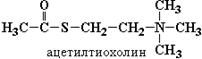 |
Главная идея использования ацетилтиохолина в качестве субстрата ацетилхолинэстеразы заключается в том, что в результате гидролиза тиоэфирной связи в этом субстрате один из продуктов реакции – тиохолин содержит сульфгидрильную группу:
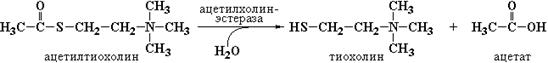 |
Накапливающийся тиохолин взаимодействует с 5,5'-дитиобис[2-нитробензойной кислотой] (реактив Эллмана) с образованием 2-нитро-5-меркаптобензойной кислоты, которая окрашена в желтый цвет, причем интенсивность окраски пропорциональна содержанию в реакционной смеси 2-нитро-5-меркаптобензойной кислоты и, следовательно, тиохолина.
Приведенные выше рассуждения позволяют сделать вывод о том, что система ацетилхолинэстераза-ацетилтиохолин является во всех отношениях удобной не только для расчета значений К m и V max реакции гидролиза ацетилтиохолина, но позволит также определить значение константы ингибирования этой реакции, К i, при использовании в качестве ингибитора естественного субстрата ацетилхолинэстеразы – ацетилхолина.
Контрольные вопросы
1. Влияние концентрации субстрата на скорость ферментативных реакций
2. Уравнение Михаэлиса–Ментен. Уравнение Лайнуивера-Берка
3. Графическое определение величины константы Михаэлиса
4. Типы ингибирования активности ферментов. Графическое определение величин констант Михаэлиса в отсутствие и в присутствии ингибиторов
5. Принцип метода определения кинетических параметров реакции гидролиза сложноэфирной связи под действием ацетилхолинэстеразы
Литература
1. Диксон М., Уэбб Э., Ферменты, т. 1, «Мир», М., 1982
2. Диксон М., Уэбб Э., Ферменты, т. 2, «Мир», М., 1982
3. Марри Р., Греннер Д., Мейес П., Родуэлл В., Биохимия человека, т. 1, «Мир», М., 1993
4. Горячковский А.М., Справочное пособие по клинической биохимии, ОКФА, Одесса, 1994
5. Степанов В.М., Молекулярная биология: структура и функции белков, под ред. академика Спирина А.С., «Высшая школа», М., 1996
6. Кнорре Д.Г., Мызина С.Д., Биологическая химия, «Высшая школа», М., 1998
7. Кольман Я., Рем К.-Г., Наглядная биохимия, «Мир», М., 2000
Ход работы
 2015-05-12
2015-05-12 578
578








