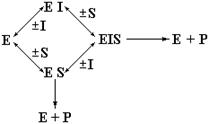
Как следует из самого термина, в этом случае конкуренция между S и I за сайт связывания отсутствует. При этом ингибитор обычно ничем не напоминает S и, как можно предполагать, связывается с участком фермента, отличным от активного центра. Обратимые неконкурентные ингибиторы снижают максимальную скорость реакции при данном количестве фермента, но, как правило, не влияют на величину K m. Поскольку I и S связываются с разными центрами, возможно образование как комплекса [EI], так и комплекса [EIS]. Комплекс [EIS] также распадается с образованием продукта, однако с меньшей скоростью, чем при распаде комплекса [ES]; поэтому в присутствии таких ингибиторов реакция замедляется, но не останавливается. Ниже указаны возможные варианты образования комплексов [ES], [EI], [EIS] и пути их распада:
На рис. 6.5 представлена зависимость 1/Vо от 1/[S] в присутствии и в отсутствие ингибитора (предполагается, что связывание I не приводит к существенным изменениям в структуре активного центра).
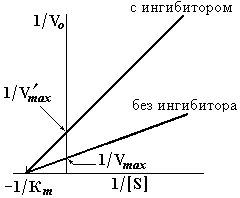 |
Рис. 6.5 Графическое изображение обратимого неконкурентного ингибирования в координатах Лайнуивера–Берка.
 2015-05-12
2015-05-12 673
673








