Групповой реактив – 2М раствор щелочи КОН, NaOH – осаждает катионы IV группы Fe2+, Fe3+, Mn2+, Bi3+, Mg2+, Sb (III), Sb(V) в виде гидроксидов Fe(OH)2 грязно-зеленого цвета, Fe(OH)3 красно-бурого цвета, Mn(OH)2, Bi(OH)3, Mg(OH)2, Sb(OH)3, SbO(OH)3 белого цвета:
Fe2+ + 2OH– → Fe(OH)2↓,
Fe3+ + 3OH– → Fe(OH)3↓,
Mn2+ + 2OH– → Mn(OH)2↓,
Bi3+ + 3OH– → Bi(OH)3↓,
Mg2+ + 2OH– → Mg(OH) ↓2,
SbCl63– +3OH– → Sb(OH)3↓ + 6Cl–,
SbCl6– + 5OH– → SbO(OH)3↓ + H2O + 6Cl–.
Осадки Fe(OH)2 и Мn(ОН)2 постепенно окисляются кислородом воздуха и изменяют свою окраску:
Fe(OH)2 + О2 + 2Н2О → Fe(OH)3↓,
красно-бурый
2Mn(OH)2 + O2 → 2МnО(ОН)2↓.
черно-бурый
При действии на катионы Fe2+, Mn2+ и Sb (III)раствора щелочи в присутствии окислителей (Н2О2, Вr2 и др.) сразу выпадают осадки Fe(OH)3, MnO(OH)2 и SbO(OH)3:
2Fe2+ + 4ОН– + Н2О2 → 2Fe(OH)3↓,
Мn2+ + 2ОН– + Н2О2 → МnО(ОН)2↓ + Н2О,
SbCl63– + 3OH– + H2O2 → SbO(OH)3↓ + 6Сl– + Н2О.
Гидроксиды катионов IV группы растворяются в разбавленных сильных кислотах, но не растворяются в избытке щелочи и в растворе аммиака:
Fe(OH)2 + 2H+ → Fe2+ + 2H2O,
Fe(OH)3 + 3H+ → Fe3+ + 3H2O,
Mn(OH)2 + 2H+ → Mn2+ + 2H2O,
Bi(OH)3 + 3H+ → Bi3+ + 3H2O,
Mg(OH)2 + 2H+ → Mg2+ + 2H2O,
Sb(OH)3 + 3H+ + 6Cl– → SbCl63– + 3H2O,
SbO(OH)3 + 5H+ + 6Сl– → SbCl– + 4H2O.
Для растворения осадка МnО(ОН)2 помимо кислоты необходимо присутствие восстановителя (Н2О2, NaNO2):
МnО(ОН)2 + 2Н++ Н2О2 → Mn2+ + O2 + ЗН2О.
Осадок Мn(ОН)2 можно растворить в достаточно концентрированном растворе НС1 при нагревании. Восстановителем в данной реакции является Сl– -ион:
МnО(ОН)2 + 4Н++ 2Сl– →Mn2+ + C12 + 3H2O.
Осаждение гидроксидов Mg(OH)2, Fe(OH)2, Mn(OH)2 растворами аммиака и щелочей неполное вследствие достаточно большой их растворимости. В присутствии солей аммония эти гидроксиды не осаждаются. Они растворяются в насыщенном растворе NH4C1. Например:
Mg(OH)2 + 2NH4C1 → MgCl2 + 2NH4OH,
Mg(OH)2 + 2NH4+ → Mg2+ + 2NH4OH.
Частные аналитические реакции ионов Fe2+
1.5.1. Гексацианоферрат(III) калия K3[Fe(CN)6] с катионом Fe2+ образует синий осадок «турнбулевой сини»:
3FeSO4 + 2K3[Fe(CN)6] →Fe3[Fe(CN)6]2↓+ 3K2SO4,
3Fe2+ + 2Fe(CN)63– → Fe3[Fe(CN)6]2↓.
Осадок не растворяется в кислотах, но разлагается щелочами с образованием Fe(OH)2. При избытке реактива осадок приобретает зеленый оттенок. Реакции мешают ионы Fe3+, которые при большой концентрации дают с реактивом бурое окрашивание раствора, и ионы Мn2+ и Bi3+, дающие с реактивом слабоокрашенные осадки, растворимые в кислотах.
Выполнение реакций. В пробирку поместить 1–2 капли раствора FeSO4 и прибавить 1 каплю реактива. Полученный осадок разделить на две части, к первой прибавить 1-2 капли 2 Мраствора НС1, ко второй– 1-2 капли 2 Мраствора щелочи. Условия проведения реакции – с разбавленными растворами в кислой среде, рН = 3.
1.5.2. Окисление Fe2+ до Fe3+. Ион Fe2+ представляет собой довольно сильный восстановитель и способен окисляться при действии ряда окислителей, например, H2O2, KMnO4, K2Cr2O7 в кислой среде и др.
2Fe2+ + 4OH– + H2O2 → 2Fe(OH)3↓.
При проведении систематического анализа Fe2+ следует открыть в предварительных испытаниях, т.к. в процессе разделения групп Fe2+ может окислиться до Fe3+.
Частные аналитические реакции ионов Fe3+
1.5.3. Гексацианоферрат(II) калия K4[Fe(CN)6] скатионами Fe3+ образует темно-синий осадок «берлинской лазури»:
4Fe3+ + 3Fe(CN)64– → Fe4[Fe(CN)6]3↓.
Осадок практически не растворяется в кислотах, но разлагается щелочами с образованием Fe(OH)3. В избытке реактива осадок заметно растворяется.
Выполнение реакции. К 1–2 каплям раствора FeCl3 прибавить 1 каплю реактива. Полученный осадок разделить на две части. К одной части прибавить 2–3 капли 2 Мраствора НС1, к другой –1–2 капли 2 Мраствора NaOH, перемешать.
1.5.4. Тиоцианат (роданид) калия KNCS с ионами Fe3+ образует комплекс кроваво-красного цвета. В зависимости от концентрации тиоцианата могут образовываться комплексы различного состава:
Fe3+ + NCS– ↔ Fe(NCS)2+,
Fe3+ + 2NCS– ↔ Fe(NCS)2+,
и т.д. до Fe3+ + 6NCS– ↔ Fe(NCS)63–,
Реакция обратима, поэтому реактив берется в избытке. Определению мешают ионы, образующие с Fe3+ устойчивые комплексы, например, фторид-ионы, соли фосфорной, щавелевой и лимонной кислот.
Частные аналитические реакции ионов Mn2+
1.5.5. Окисление висмутатом натрияNaBiO3, протекает по уравнению:
2Mn(NO3)2 + 5NaBiO3 + 16HNO3 = 2HMnO4 + 5Bi(NO3)3 +
+ 5NaNO3 + 7H2O.
Реакция идет на холоду.
Выполнение реакции: к 1-2 каплям раствора соли марганца прибавляют 3-4 капли 6 М раствора HNO3 и 5-6 капель H2O, после чего вносят лопаточкой немного порошка NaBiO3. перемешав содержимое пробирки, дают постоять 1-2 минуты, центрифугируют для отделения избытка висмутата натрия. В присутствии Mn2+ раствор становится фиолетовым в результате образования марганцевой кислоты, которая является одним из наиболее сильных окислителей.
1.5.6. Окисление двуокисью свинца PbО2 в азотнокислой среде при нагревании:
2Mn(NO3)2 + 5РbО2 + 6HNO3 → 2HMnO4 + 5Pb(NO3)2 + 2Н2О.
Выполнение реакции: Берут немного порошка PbO2 и помещают в пробирку, туда же добавляют 4-5 капель 6 M HNO3, нагревают при перемешивании. Появление фиолетовой окраски свидетельствует о наличии Mn2+.
1.5.7. Важное значение в анализе имеют реакции Mn2+ c карбонатами щелочных металлов, гидрофосфатом натрия, реакции окисления персульфатом аммония, окисление бензидина соединениями Mn4+, восстановление AgCl до металлического серебра ионами Mn2+.
Частные аналитические реакции ионов Bi3+
1.5.8. Гидролиз – одна из характерных реакций катиона Bi3+. При разбавлении растворов солей висмута – Bi(NO3)3 и особенно BiCl3 – выпадает белый осадок основной соли:
Bi3++ Сl– + Н2О → BiOCl↓+ 2H+.
Формула BiOCl (и другие аналогичные формулы, например SbOCl) отражает не реальный, а формальный состав осадка, так как иона BiO+ не существует.
Полученный осадок растворяется в сильных кислотах:
BiOCl + 2Н+ →Bi3+ + Cl– + H2O.
Выполнение реакций. 1–2 капли раствора BiCl3 сильно разбавить водой. К полученному осадку прибавить несколько капель 2 Мраствора НС1 до растворения осадка.
1.5.9. Станниты натрия Na2SnO2 и калия К2SnO2 восстанавливает в щелочной среде ион Bi3+ до металлического висмута, выпадающего в виде осадка черного цвета:
2Bi(OH)3 + 3Na2SnO2 → 2Bi↓ + 3Na2SnO3 + ЗН2О,
2Bi(OH)3 + 3 SnO22– →2Bi↓ + 3 SnO32– + 3H2O.
Выполнение реакций. В отдельной пробирке приготовить раствор станнита натрия. Для этого к 2–3 каплям раствора SnCl2 прибавить избыток 2Мраствора NaOH до растворения первоначально образовавшегося осадка Sn(OH)2. К полученному щелочному раствору прибавить 2 капли раствора BiCl3.
1.5.10. Важное значение в анализе имеют реакции катонов висмута с аммиаком, бихроматом калия, гидрофосфатом натрия, иодидом калия.
Частные аналитические реакции ионов Mg2+
1.5.11. Гидрофосфат натрия Na2HPO4 образует скатионами Mg2+ в присутствии NH4OH и соли аммония при рН =9 белый кристаллический осадок MgNH4PO4∙6H2O:
MgCl2 + Na2HPO4 + NH4OH → MgNH4PO4↓ + 2NaCl + H2O,
Mg2+ + HPO42– + NH4OH → MgNH4PO4↓ + H2O.
При проведении реакции следует точно поддерживать рН = 9.
Выполнение реакции. В пробирку поместить 2–3 капли раствора MgCl2, прибавить 3–4 капли 2 Мраствора НС1 и 2–3 капли раствора Na2HPO4. Затем прибавить 1 каплю фенолфталеина и по каплям при перемешивании прибавлять 2 Мраствор NH4OH до слабо-розовой окраски раствора (рН = 9). Осадок MgNH4PO4 склонен к образованию устойчивых пересыщенных растворов, поэтому при его получении необходимо энергичное перемешивание реакционной смеси.
1.5.12. Магнезон I (n-нитробензолазорезорцин) или магнезон II (n-нитробензолазо-а-нафтол) при взаимодействии с ионами Mg2+ в щелочной среде образуют адсорбционные соединения синего цвета:
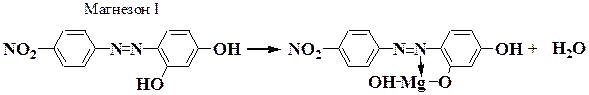
Реакция основана на осаждении Mg(OH)2 с последующей адсорбцией красителя на поверхности гидроокиси магния.
Выполнение реакции. К 2–3 каплям раствора MgCl2 прибавить 1 каплю щелочного раствора магнезона. Переход красно-фиолетовой окраски в синюю свидетельствует о наличии ионов магния. Если раствор окрасился в желтый цвет (рН < 7), добавить несколько капель щелочи.
1.5.13. Реакция с титановым желтым. К 2-3 каплям раствора, содержащего ион Мn2+ (рН ≥ 7), приливают 2-3 каляи титанового желтого и 1 мл 2 М КОН. В присутствии ионов магния раствор окрашивается в красный цвет, при слабом подогреве выпадает красный осадок.
 2015-05-13
2015-05-13 4157
4157
