В солянокислом растворе ионы Sb (III)присутствуют в виде комплексов SbCl63–
1.5.14. Гидролиз солей сурьмы идет даже при небольшом разбавлении их водой с образованием основных солей белого цвета:
SbCl63– + 2H2O → SbO2Cl↓ + 5Сl– + 4Н+.
Осадок растворяется в избытке НС1 собразованием соответствующих комплексов:
SbOCl + 2Н++ 5Сl– →SbCl63– +H2O,
Выполнение реакции. 3–4 капли раствора соли Sb (III)разбавить водой. Полученный осадок исследовать на растворимость в растворе НС1.
1.5.15. Восстановление Sb3+ до металлической сурьмы оловом.
2SbCl63– + 3Sn → 2Sb↓ + 3Sn2+ + 12Сl–.
Выполнение реакции. На кусочек оловянной фольги поместить каплю солянокислого раствора соли сурьмы (III) и дать постоять. Через некоторое время образуется черное пятно металлической сурьмы, которое не исчезает при обработке его свежеприготовленным раствором висмутата натрия NaBiO3.
1.5.16. Действие метилового фиолетового. Метиловый фиолетовый представляет собой хлорид органического основания и имеет строение:
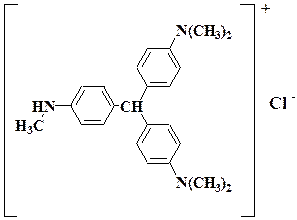
Для выполнения этой реакции необходимо окислить Sb3+ до Sb5+. В присутствии Sb5+ появляется суспензия кристаллов соли, образованной органическим катионом красителя с анионом [SbСl6]–, окрашенная в фиолетовый цвет.
Выполнение реакции. К 2-3 каплям раствора, содержащего ионы Sb3+, приливают 2-3 капли концентрированной HCl и 2-3 капли 1 М раствора нитрита калия KNO2 для окисления трехвалентной сурьмы в пятивалентную. Содержимое пробирки выдерживают не менее 1 мин. для завершения реакции, прибавляют 1 мл насыщенного раствора мочевины CO(NH2)2 до прекращения вспенивания. Полученный раствор разбавляют до 3-5 мл водой, а затем прибавляют 3-4 капли 0,06 % водного раствора метилового фиолетового. В присутствии сурьмы возникает фиолетовая или темно-синяя окраска. В отсутствие сурьмы раствор имеет желто-зеленую окраску.
1.5.17. В анализе находят применение реакции Sb3+ с фосфорномолибденовой кислотой H3[PMo12O40]·xH2O, тетраиодомеркуратом калия K2[HgI4], оксихинолином, тиосульфатом натрия.
Контрольные вопросы:
1. Какими свойствами обладают гидроксиды катионов IV группы?
2. Почему при разделении катионов IV и V групп помимо избытка щелочи рекомендуется прибавить пероксид водорода?
3. На чем основано отделение Mg2+ от остальных катионов IV группы?
4. Какое свойство солей Sb (III) положено в основу их обнаружения?
5. Какие катионы IV группы можно обнаружить дробным методом?
6. Какие катионы IV группы можно обнаружить с помощью окислительно-восстановительных реакций?
7. При действии щелочей на смесь катионов IV группы выпал белый осадок. Какие катионы отсутствуют в исследуемом растворе?
8. Какую роль играет Н2О2 при растворении осадка МnО(ОН)2 в разбавленных кислотах?
9. Какова роль нитрата серебра окислении Мn2+ персульфатом аммония?
10. Какой ион образуется при окислении Мn2+ сильными окислителями в кислой среде? Какова его окраска?
11. С помощью какого вещества можно разделить основные соли Bi(III) и Sb(III)?
 2015-05-13
2015-05-13 2438
2438








