Раствор NH4OH, прибавленный к растворам солей катионов V группы в эквивалентных количествах, осаждает эти катионы в виде белых или окрашенных основных солей, гидроксидов и амидокомплексов:
2CuSO4 + 2NH4OH →(CuOH)2SO4↓ + (NH4)2SO4,
голубовато-зеленый
CoCl2 + NH4OH → CoOHCl↓ + NH4Cl,
синий
2NiSO4 + 2NH4OH →(NiOH)2SO4↓ + (NH4)2SO4,
светло-зеленый
CdCl2 + 2NH4OH → Cd(OH)2↓ + 2NH4Cl,
белый
HgCl2 + 2NH4OH → [HgNH2]Cl↓ + NH4C1 + 2H2O.
белый
В избытке NH4OH эти осадки растворяются с образованием амминокомплексов различной окраски. Образование комплекса гексаамминкобальта (II) и тетраамминртути(II) происходит в присутствии NH4C1 при нагревании:
(CuOH)2SO4 + 8NH4OH → 2[Cu(NH3)4]2+ + SO42– + 2ОН– + 8Н2О,
ярко-синий
CoOHCl + 5NH4OH + NH4+ → [Co(NH3)6]2++ Сl– + 6Н2О,
желто-бурый
(NiOH)2SO4 + 12NH4OH → 2Ni(NH3)62+ + SO42– + 2OH– + 12H2O,
синий
Cd(OH)2 + 4NH4OH → [Cd(NH3)4]2+ + 2OH– + 4H2O,
бесцветный
[HgNH2]Cl+2NH4OH + NH4+ → [Hg(NH3)4]2+ + Сl– + 2H2O.
бесцветный
Гексаамминкобальт(II) окисляется кислородом воздуха до гексаамминкобальта (III) вишнево-красного цвета. В присутствии окислителей (Н2О2) образование гексаамминкобальта (III) происходит мгновенно:
2СоС12 + 10NH4OH + 2NH4C1 + Н2О2 → 2[Co(NH3)6]C13 + 12Н2О.
Выполнение реакций. В пять пробирок поместить по 3 капли растворов солей Cu2+, Ni2+, Co2+, Cd2+ и Hg2+ и прибавить в каждую 1–2 капли 2 Мраствора NH4OH. К полученным осадкам основных солей меди, никеля и кадмия прибавить при перемешивании несколько капель концентрированного раствора NH4OH до растворения осадков. Осадок основной соли кобальта разделить на две части. К одной прибавить 3 – 4 капли 3 % раствора Н2О2, а затем обе части осадка растворить, прибавив несколько капель концентрированного раствора NH4OH и насыщенного раствора NH4C1. Осадок амидокомплекса ртути растворить в нескольких каплях концентрированного раствора NH4OH и насыщенном растворе NH4C1 при нагревании.
Частные аналитические реакции ионов Сu2+
1.6.1. Гексацианоферрат(II) калия K4[Fe(CN)6] осаждает ион Сu2+ в виде гексацианоферрата(II) меди красно-бурого цвета:
2Cu2+ + Fe(CN)62– →Cu2[Fe(CN)6]↓.
Осадок не растворяется в разбавленных кислотах, но разлагается щелочами с образованием Сu(ОН)2.
Выполнение реакции. К 2–3 каплям раствора CuSO4 прибавить 1–2 капли реактива. Осадок разделить на две части, к одной прибавить 2–3 капли 2 Мраствора НС1, к другой – 2–3 капли 2 Мраствора NaOH.
1.6.2. Тиосульфат натрия Na2S2O3 при нагревании осаждает сульфид одновалентной меди:
2CuSO4 + 2Na2S2O3 + H2O → Cu2S↓ + 2S + 2Na2SO4 + Н2SO4.
Выполнение реакции. В пробирку поместить 2–3 капли раствора CuSO4, прибавить 4–5 капель воды, 2–3 капли 1 Мраствора H2SO4 (до явно кислой реакции) и полуторакратное количество насыщенного раствора тиосульфата натрия Na2S2O3. Перемешать, нагреть. Образование темно-бурого осадка смеси Cu2S с серой свидетельствует о присутствии меди в растворе. Так как Cd2+ при действии тиосульфата натрия в кислой среде не образует осадка сульфида, эта реакция может быть использована для отделения Cu2+ от Cd2+.
1.6.3. Раствор аммиака, взятый без избытка, образует с раствором соли меди осадок Cu(OH)2SO4 сине-зеленого цвета. Осадок растворим в разбавленных кислотах и в избытке аммиака. При растворении в избытке аммиака образуется комплексное соединение [Cu(NH3)4]2–, окрашенное в ярко-синий цвет.
[Cu(OH)2]SO4 + 10NH4OH → 2[Cu(NH3)4](OH)2 + (NH4)2SO4 + 8H2O.
Выполнение реакции. К 5-6 каплям раствора, содержащего ионы меди, прибавляют 2-3 капли концентрированного аммиака и взбалтывают. Интенсивно-синяя окраска раствора указывает на присутствие ионов Cu2+.
1.6.4. Реакция окрашивания пламени. Соли меди окрашивают бесцветное пламя горелки в синий или зеленый цвет.
Частные аналитические реакции ионов Co2+
1.6.5. Роданид аммония NH4NCS в присутствии амилового спирта образует с катионами Со2+ тетратиоцианаткобальтат (II) аммония синего цвета, экстрагируемый амиловым спиртом:
CoCl2 + 4NH4NCS → (NH4)2[Co(NCS)4] + 2NH4Cl.
Этот комплекс малоустойчив, поэтому необходим избыток реактива. Устойчивость комплексного иона повышается в органическом растворителе. Ионы Сu2+ мешают реакции, образуя с реактивом комплексный ион Cu(NCS)42+ желто-бурого цвета.
Выполнение реакции. К 2–3 каплям раствора СоСl2 прибавить 3-4 кристаллика NH4NCS и 5–6 капель амилового спирта, встряхнуть.
Открытию кобальта данной реакцией мешают Fe3+ и Bi3+, дающие с роданидом аммония окрашенные соединения. Висмут образует комплекс желтого цвета, который не окрашивает слой органического растворителя, роданид железа – комплекс ярко-красного цвета затемняет синюю окраску роданида кобальта, поэтому, если в растворе присутствует Fe3+ его необходимо восстановить до Fe2+. Восстановление проводят, добавляя раствор Sn2+.
Выполнение реакции. К 5-6 каплям исследуемого раствора добавляют равный объем роданида аммония, в присутствии Fe3+ появляется красное окрашивание. Прибавляют раствор SnCl2 до исчезновения окраски.
FeCl3 + SnCl2 ↔ 2FeCl2 + SnCl4
Затем прибавляют 0,5 см3 амилового спирта и взбалтывают. В присутствии Co2+ слой амилового спирта окрашивается в синий цвет.
1.6.6. Важное значение в анализе имеют реакции ионов кобальта с гидрофосфатом натрия, тетрароданомеркуратом аммония (NH4)2[Hg(SCN)4].
Частные аналитические реакции ионов Ni2+
1.6.7. Диметилглиоксим (реактив Чугаева) осаждает катионы Ni2+ в аммиачной среде в виде внутрикомплексного соединения ало-красного цвета:
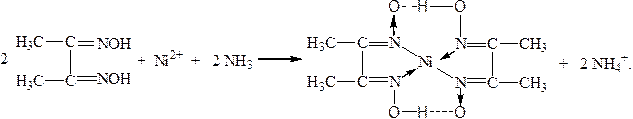 Осадок растворим в сильных кислотах и заметно растворим в концентрированном растворе NH4OH. Реакции мешают ионы Fe2+, поэтому для обнаружения никеля необходимо добавление бензола или амилового спирта, которые экстрагируют диметилглиоксимат никеля и окрашиваются при этом в малиновый цвет. Выполнение этой реакции следует проводить при рН = 5 ÷ 10, следует избегать большого избытка NH4OH, так как может образоваться аммиачный комплекс никеля.
Осадок растворим в сильных кислотах и заметно растворим в концентрированном растворе NH4OH. Реакции мешают ионы Fe2+, поэтому для обнаружения никеля необходимо добавление бензола или амилового спирта, которые экстрагируют диметилглиоксимат никеля и окрашиваются при этом в малиновый цвет. Выполнение этой реакции следует проводить при рН = 5 ÷ 10, следует избегать большого избытка NH4OH, так как может образоваться аммиачный комплекс никеля.
Выполнение реакции. К 2–3 каплям раствора, содержащего соль никеля добавить 2-3 капли раствора диметилглиоксима, 2-3 капли 2 М раствора NH4OH и 5 капель амилового спирта или бензола. В присутствии Ni2+ слой органического растворителя окрашивается в малиновый цвет.
Частные аналитические реакции ионов Cd2+
1.6.8. Сероводород H2S в кислых, нейтральных и щелочных растворах (при рН ≥ 0,5) образует с ионами кадмия желтый осадок CdS, нерастворимый в едких щелочах и сульфиде.
CdSO4 + H2S ↔ CdS↓ + H2SO4
В присутствии ионов меди реакцию проводят так: нейтральный или слабокислый раствор нагревают и прибавляют к нему свежеприготовленный раствор сероводорода до полного осаждения CuS и CdS. Осадок отделяют и нагревают со смесью: 5 капель 2 М раствора HCl и 5 капель воды, при этом сульфид кадмия растворяется, а сульфид меди остается в осадке. Отделив осадок, центрифугат в 2 раза разбавляют водой и действуют сероводородной водой, образование желтого осадка свидетельствует о наличии кадмия.
1.6.9. Иодид калия KI (избыток) в присутствии избытка NH4OH образует белый осадок комплексной соли иодида тетраамминкадмия:
Cd(NO3)2 + 4NH4OH + 2KI → [Cd(NH3)4]I2 + 2KNO3 + 4H2O
Контрольные вопросы
1. Какое свойство катионов V группы позволяет выделить их в отдельную аналитическую группу?
2. Почему амминокомплекс Со (II) образуется только при большом избытке аммиака?
3. В какой цвет окрашены аммиакаты катионов V группы?
4. Что произойдет при подкислении амминокомплекса Сu (II)? Как при этом изменится окраска раствора?
5. При помощи какого реактива можно осадить ионы меди в виде сульфида?
6. Каковы условия образования комплекса Co(NCS)42–?
7. При действии концентрированного раствора аммиака на смесь катионов V группы получили бесцветный раствор. О присутствии или отсутствии каких катионов это свидетельствует?
8. Какими реактивами можно разделить следующие катионы: Zn2+ и Сu2+? А13+ и Ni2+? Mg2+ и Cd2+? Mg2+ и Fe3+? Cu2+ и Cd2+?
9. Присутствие каких катионов возможно в анализируемой смеси, если при растворении ее в воде образовался белый осадок?
10. При действии на смесь катионов IV—V групп избытка щелочи и пероксида водорода образовался черно-бурый осадок. Присутствие каких катионов возможно?
11. Как можно растворить осадки Fe(OH)3, Mg(OH)2, Cd(OH)2, MnO(OH)2?
 2015-05-13
2015-05-13 5094
5094
