3Na2S + 2CrCI3 + 6H2O⇆2Cr(OH)3¯ + 3H2S + 6NaCI
+ + реакция идет до полного
H2O H2O растворения солей
HS− + OH −⇆ H+ + CrOH2+
↓
H2O
Константа и степень гидролиза. Расчет рН растворов
Солей
Количественно процесс гидролиза характеризуется: 1) степенью гидролиза h; 2) константой гидролиза К гидр
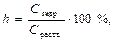
где h – степень гидролиза, показывает какая доля растворимой соли подверглась гидролизу; С гидр – число гидролизовавшихся молекул соли; С раств – общее число молекул соли.
Степень гидролиза зависит от химической природы образующихся при гидролизе кислоты или основания и будет тем больше, чем слабее кислота и основание.
Если соль образована слабой кислотой и сильным основанием
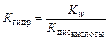
Если соль образована сильной кислотой и слабым основанием
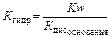
Если соль образована слабой кислотой и слабым основанием
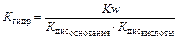
Гидролиз кислых и основных солей. Рассмотрим гидролиз солей NaH2PO4 и РbОНСI. Для этого необходимо учитывать следующие возможные процессы:
а) первичную диссоциацию соли на ионы, протекающую практически нацело
NaH2PO4⇆Na + H2PO4–
РbОНСI⇆РbОН+ + СI–
б) вторичную диссоциацию сложных ионов
H2PO4–⇆H+ + HPO42–
РbОН+⇆Рb+2 + ОН–
в) гидролиз сложных ионов
H2PO4– + Н2О⇆H3PO4 + ОН–
РbОН+ + Н2О⇆Рb(ОН)2 + Н+
Процессы а определяют исходную концентрацию сложных ионов в растворе; которая будет равна концентрации соли, так как соли – сильные электролиты. Процессы б и в определяют равновесную концентрацию простых и сложных ионов в растворе, а также концентрацию Н+ и ОН–.
Чтобы определить, какую реакцию имеет раствор кислой соли, например NaH2PO4, кислую или щелочную, следует определить, какой процесс протекает в большей степени: диссоциация (б) или гидролиз (в). Для этого надо сравнить К дис с К гидр:
Кдис2 = 6 · 10–8,
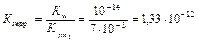
Т.к. К дис2 > К гидр, то среда кислая.
 2015-05-13
2015-05-13 2117
2117
