Для сравнения окислительно-восстановительной способностиразличных соединений используют величины окислительно-восстановительных или редокс-потенциалов. Если металлическую пластинку опустить в раствор электролита, содержащего ионы этого металла, устанавливается равновесие:
Мео«Ме+ n + 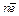
Возможны два процесса:
Анод: Meo - 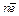 ®Me+ n окисление
®Me+ n окисление
Катод: Me+ n + 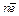 ®Meo восстановление
®Meo восстановление
Пластина, которую опустили в раствор электролита, называют электродом. Электрод, на котором идет восстановление, называют катодом, на котором идет окисление – анодом. Вследствие того, что на электроде идет процесс либо окисления, либо восстановления, меняется заряд около электродного баланса и на границе металл (электрод)/раствор возникает перепад напряжения, который называется электродным потенциалом данного электрода.
Если металл погрузить в раствор его ионов (С = 1 моль/л), то устанавливающийся при стандартных условиях (температуре 25°С и давлении 101 325 Па) потенциал называют стандартным электродным потенциалом, для которого значение потенциала принято равным нулю. Таким электродом для водных растворов принят водородный электрод, который представляет собой пористую платиновую пластину, погруженную в раствор кислоты. Через раствор пропускают газообразный водород и на границе электрод/раствор идут два обратимых процесса:
2Н+ + 2  ®Н2о
®Н2о
Н2о - 2  ®2Н+
®2Н+ 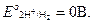
Пусть два металла (цинк и медь) погружены в растворы их солей, которые разделены пористой перегородкой. Металлические пластины – электроды ячейки, соединенные через вольтметр. На электродах протекают реакции:
Анод: Zn(тв)→Zn2+(р-р) + 2 
Катод: Cu2+(р-р) + 2  →Cu(тв)
→Cu(тв)
Цинк заряжается отрицательно, а медь – положительно; электроны движутся во внешней цепи от цинка к меди. Цинковый электрод, растворяясь, посылает в раствор ионы цинка, а ионы меди осаждаются из раствора на медном электроде. Ионы движутся через пористую перегородку.
Гальванический элемент – устройство, в котором на основе окислительно-восстановительной реакции возникает электрический ток, т.е. энергия химической реакции превращается в электрическую.
Гальванический элемент принято выражать схемой. Слева в схеме записывают электрод (анод) с отрицательным знаком, затем электролит, в котором он находится; далее электролит, в который погружен электрод (катод), и электрод (катод) с положительным знаком. Электроды в схеме отделяются сплошной вертикальной линией, а растворы двумя линиями.
Для медно-цинкового элемента схема имеет следующий вид:
полная (–) Zn/ZnSO4//CuSO4/Cu (+)
краткая (-) Zn/Zn2+//Cu2+/Cu (+)
Электродвижущая сила (ЭДС) гальванического элемента характеризует способность электронов к движению во внешней цепи. В обратимых условиях ЭДС равна разности потенциалов двух электродов. Условились, что в гальваническом элементе ЭДС (Е) направлена (слева направо):
ЕЭДС = Екатода - Еанода.
 2015-05-13
2015-05-13 350
350








