Для количественной характеристики окислительно-восстановительной способности веществ используют у равнение Нернста:
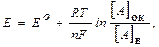
где R − универсальная газовая постоянная; Т − температура, К; n - число электронов, участвовавших в реакции электрохимического превращения 1 моль вещества; F - число Фарадея (96 500 Кл).
При температуре Т = 298 К отношение
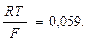
Связь между изменением энергии Гиббса и ЭДС реакции:
DG = - n · F · E,
где n – число электронов окислителя или восстановителя; F – число Фарадея; E – электродвижущая сила процесса (Э.Д.С.).
ЭДС зависит от окислительно-восстановительных или электродных потенциалов j, характеризующих энергию, с которой и окислитель и восстановитель удерживают электроны. Так как окислитель отбирает электроны у восстановителя, то его потенциал должен быть больше потенциала восстановителя и тогда: DЕ (ЭДС) = Еок. − Евос. Если DЕ > 0, то происходит самопроизвольное протекание реакции в прямом направлении.
Следует учесть, что DЕ характеризует только термодинамическую вероятность протекания самопроизвольной реакции, но не ее скорость.
Вопросы для самоподготовки
1. Какие реакции называются окислительно-восстановительными (ОВР)? Что является необходимым термодинамическим условием их протекания в растворе?
2. Что называют степенью окисления атома? Вычислите степень окисления серы в соединениях: H2S, Na2SO3, H2SO4, Na2S2O3.
3. Дайте определение окислителя, восстановителя, процесса окисления и восстановления.
4. Как определить, исходя из положения элемента в периодической системе Д.И. Менделеева, какую: а) низшую; б) высшую; в) промежуточную степень окисления он проявляет?
5. Типы окислительно-восстановительных реакций.
6. Исходя из степени окисления азота, серы и марганца в соединениях: NH3, HNO2, HNO3, H2S, S, H2SO4, KMnO4, MnO2, MnSO4, определите, какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства?
7. Способы уравнивания ОВР. Уравняйте методом электронного баланса следующие реакции и укажите их тип:
MgO + CI2 + C®MgCI2 + CO; AgNO3®Ag + NO2 + O2
8. Закончите окислительно-восстановительные реакции, используя ионно-электронный метод:
NaBr + MпO2 + H2SO4®MпSO4 +...
NaNO2 + KMnO4 + H2O®...
Na2SO3 + KMnO4 + KOH®.....
C + K2Cr2O7 + H2SO4→CO2 +….
9. Определите направление протекания реакции:
Hg + H2SO4(конц.)®HgSO4 + SO2 + H2O
10. Вычислите эквивалент и молярную массу эквивалента K2CrO4 как окислителя, если K2CrO4 восстанавливается до KCrO2.
11. Ион какого галогена (CI-, Br- или I-) будет восстанавливать Fe+2 в Fe+3?
ТЕСТЫ
1.Коэффициент перед молекулой восстановителя в уравнении реакции K2Cr2O7 + NaNO2 + H2SO4 = Cr2(SO4)3 + NaNO3 + K2SO4 + H2O равен:
а) 3;
б) 6;
в) 4;
г) 2.
2. Какие из перечисленных веществ обладают восстановительными свойствами:
а) NH3;
б) HNO3;
в) KMnO4;
г) H2SO4.
3. Окислителем в реакции
KMnO4 + KNO2 + H2SO4 = MnSO4 +K2SO4+ KNO3 + H2O является:
а) H2SO4;
б) KNO2;
в) KMnO4;
г) KNO3.
4. Коэффициент перед молекулой окислителя в уравнении реакции
CrCI3 + Br2 + KOH = K2CrO4 + KBr + KCI + H2O равен:
а) 3;
б) 4;
в) 5;
г) 6.
5. Для того, чтобы определить направление окислительно-восстановительной реакции, необходимо рассчитать…
а) элекродвижущую силу;
б) силу тока;
в) свободную энергию Гиббса;
г) температуру.
 2015-05-13
2015-05-13 1031
1031
