KMnO4 + HCI®MnCI2 + CI2 + KCI + H2O
1. Определяют степень окисления тех атомов, которые изменяют ее в процессе реакции и записывают ее значения над символом элементов:
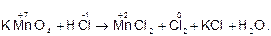
2. По изменению степени окисления определяют окислитель и восстановитель: в процессе реакции степень окисления атомов марганца изменилась от +7 до +2, следовательно атомы марганца восстановились, и таким образом, KMnO4 является окислителем. Степень окисления атомов хлора повысилась с -1 до 0, т.е. атомы хлора окислились до свободного хлора, следовательно, соляная кислота является восстановителем.
3. Записывают уравнения электронного баланса и подбирают коэффициенты, на которые их следует умножить перед суммированием.
 2CI-1 - 2
2CI-1 - 2  = CI20 5 окисление, восстановитель
= CI20 5 окисление, восстановитель
Mn+7 +5  = Mn+2 2 восстановление, окислитель
= Mn+2 2 восстановление, окислитель
4. Найденные коэффициенты переносят в уравнение реакции, далее подбирают коэффициенты перед остальными реагентами.
2KMnO4 + 10HCI®2MnCI2 + 5CI2 + 2KCI + 5H2O
5. Правильность полученного уравнения проверяют, подсчитав число атомов кислорода в левой и правой частях (по 8 атомов).
Данная реакция относится к реакциям межмолекулярного окисления-восстановления, так как окислитель и восстановитель находятся в разных молекулах.
 2015-05-13
2015-05-13 1235
1235








