Белки — высокомолекулярные природные полимеры, состоящие из аминокислотных остатков, соединенных пептидной связью; являются главной составной частью живых организмов и молекулярной основой процессов жизнедеятельности.
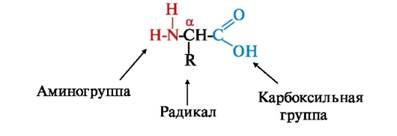
В природе известно более 300 различных аминокислот, но только 20 из них входят в состав белков человека, животных и других высших организмов. Каждая аминокислота имеет карбоксильную группу, аминогруппу в α-положении (у 2-го атома углерода) и радикал (боковую цепь), отличающийся у различных аминокислот. При физиологическом значении рН (~7,4) карбоксильная группа аминокислот обычно диссоциирует, а аминогруппа протонируется.
Все аминокислоты (за исключением глицина) содержат асимметричный атом углерода (т. е. такой атом, все четыре валентные связи которого заняты различными заместителями, он называется хиральныи центром), поэтому могут существовать в виде L- и D-стереоизомеров (эталон – глицериновый альдегид):
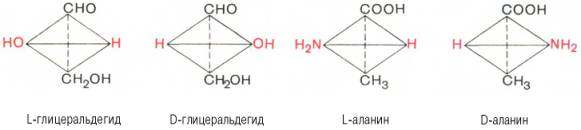
Для синтеза белков человека используются только L-аминокислоты. В белках с длительным сроком существования L-изомеры медленно могут приобретать D-конфигурацию, причем это происходит с определенной, характерной для каждой аминокислоты скоростью. Так, белки дентина зубов содержат L-аспартат, который переходит в D-форму при температуре тела человека со скоростью 0,01% в год. Поскольку дентин зубов практически не обменивается и не синтезируется у взрослых людей в отсутствие травмы, по содержанию D-аспартата можно установить возраст человека, что используется в клинической и криминалистической практике.
Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическим свойствам радикалов, присоединённых к α-углеродному атому.
Структурные формулы 20-ти протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
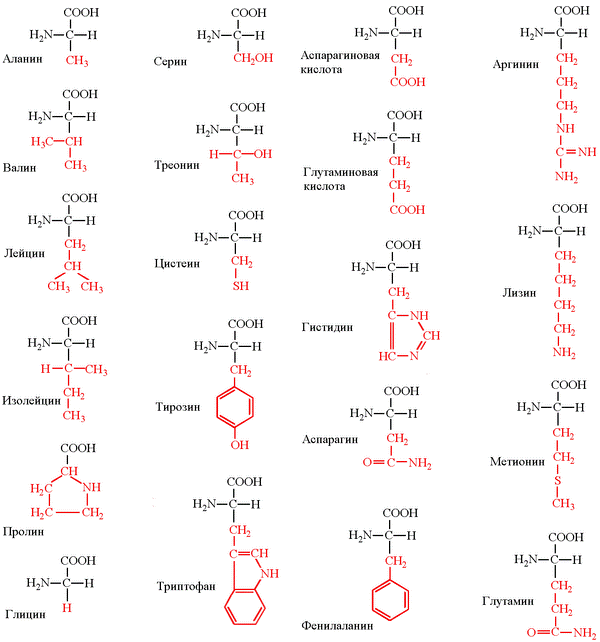
В последнее время для обозначения аминокислот используют однобуквенные обозначения, для их запоминания используется мнемоническое правило (четвертый столбец).
| Глицин | Gly | G | Glycine | Гли |
| Аланин | Ala | A | Alanine | Ала |
| Валин | Val | V | Valine | Вал |
| Изолейцин | Ile | I | Isoleucine | Иле |
| Лейцин | Leu | L | Leucine | Лей |
| Пролин | Pro | P | Proline | Про |
| Серин | Ser | S | Serine | Сер |
| Треонин | Thr | T | Threonine | Тре |
| Цистеин | Cys | C | Cysteine | Цис |
| Метионин | Met | M | Methionine | Мет |
| Аспарагиновая кислота | Asp | D | asparDic acid | Асп |
| Аспарагин | Asn | N | asparagiNe | Асн |
| Глутаминовая кислота | Glu | E | gluEtamic acid | Глу |
| Глутамин | Gln | Q | Q-tamine | Глн |
| Лизин | Lys | K | before L | Лиз |
| Аргинин | Arg | R | aRginine | Арг |
| Гистидин | His | H | Histidine | Гис |
| Фенилаланин | Phe | F | Fenylalanine | Фен |
| Тирозин | Tyr | Y | tYrosine | Тир |
| Триптофан | Trp | W | tWo rings | Три |
Существуют разные классификации аминокислот. Одна из них основана на характеристике интенсивности молекулярного взаимодействия бокового радикала с водой.
1. Гидрофобные (неполярные) (гли, ала, вал, лей, про, иле, три, фен).
2. Гидрофильные (полярные):
а) незаряженные (сер, тре, цис, асн, глн, тир*, мет*);
б) заряженные:
- отрицательно заряженные (глу, асп);
- положительно заряженные (лиз, арг, гис).
*некоторые источники относят тир и мет к гидрофобным аминокислотам.
Гидрофильные вещества интенсивно взаимодействуют с молекулами воды, они содержат полярные химические связи. Гидрофобность – это физическое свойство молекулы, которая «стремится» избежать контакта с водой. Гидрофобные молекулы обычно неполярны и «предпочитают» находиться среди других нейтральных молекул и неполярных растворителей. Гидрофильность и гидрофобность являются проявлением сил Ван-дер-Ваальса (группа слабых взаимодействий). Эти взаимодействия в основном определяют силы, ответственные за формирование пространственной структуры биологических макромолекул.. Пространственная структура воды стремится вытеснить гидрофобные группы, нарушающие сеть из связанных водородными связями молекул воды. Такое выталкивание из водного раствора и называют гидрофобным взаимодействием. Известно, что биологические биополимеры функционируют в водном окружении и именно наличие гидрофобных связей в значительной мере определяет форму, которую приобретает макромолекула.
Можно классифицировать аминокислоты по строению радикала:
1. Алифатические (гли, ала, вал, лей, илей).
2. Гидроксиаминокислоты (сер, тре).
3. Дикарбоновые (асп, глу).
4. Амиды дикарбоновых кислот (асн, глн).
5. Серосодержащие (мет, цис).
6. Циклические (фен, тир, три, гис).
7. Диаминомонокарбоновые (лиз, арг).
8. Иминокислота (про).
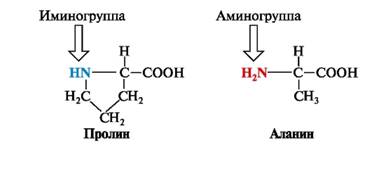
В состав белков человека входит 19 аминокислот и 1 циклическая иминокислота - пролин, имеющая иминогруппу -NH-. Роль гидрофобного радикала в этой молекуле играет насыщенная алифатическая трехуглеродная цепь, образующая 5-членный цикл между α-углеродным атомом и иминогруппой:
Некоторые белки содержат аминокислоты с модифицированными радикалами, отсутствующие в других белках. Так, в полипептидную цепь коллагена входит гидроксилизин, эластина и коллагена - гидроксипролин. Факторы свертывания крови протромбин, проконвертин, белки костной ткани остеокальцин, сиалопротеин содержат γ-карбоксиглутаминовую кислоту:
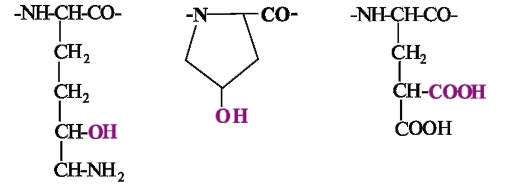
Гидроксилизин Гидроксипролин γ-Карбоксиглутаминовая кислота
Модификация радикалов таких аминокислот обычно происходит уже после включения их в полипептидную цепь, т.е. на постсинтетическом периоде.
Существует еще одна классификация аминокислот, по способности организма синтезировать их из предшественников:
Незаменимые для человека: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан, аргинин (незаменима для детей), гистидин.
Заменимые для человека: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Мнемоническое правило для запоминания заменимых и незаменимых аминокислот:
| Фенилаланин | Валин | Метионин |
| Лизин | Лейцин | Треонин |
| Аргинин* | Изолейцин | |
| Гистидин | Триптофан |
 2015-05-13
2015-05-13 15608
15608