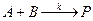
Уравнение скорости для рассматриваемой реакции
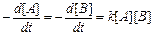
Обозначим начальные концентрации A и B через a и b; примем, что через время t прореагирует количество A равное x; тогда концентрации A и B в момент времени t будут равны (a-x) и (b-x) соответственно. Выражение скорости реакции будет следующим:
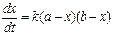
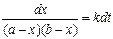
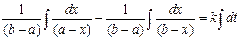 ;
;
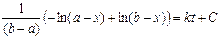 ; C– постоянная интегрирования.
; C– постоянная интегрирования.
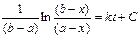 ; C находим из начальных условий: x=0 при t=0.
; C находим из начальных условий: x=0 при t=0. 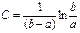 .
.
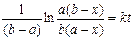 или
или 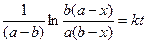
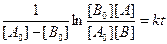
Графическое определение кинетических параметров уравнения второго порядка показано на рис. 1.1.7.
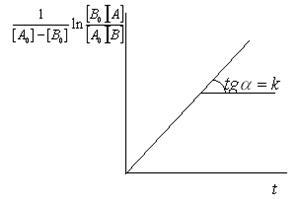
Рис. 1.1.7. Графическое определение константы скорости реакции второго порядка на основании экспериментальной зависимости концентрация – время.
В особом случае, когда A и B являются молекулами одного и того же вещества, т.е.
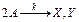
либо начальные концентрации A и B равны [A0]=[B0], выражение скорости реакции будет иметь следующий вид:
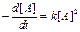 или
или 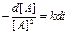
Интегрируя, получаем
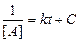 ; при t=0,
; при t=0, 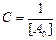 ; [A0]– начальная концентрация вещества A.
; [A0]– начальная концентрация вещества A.
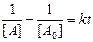
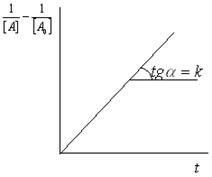 | 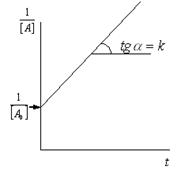 |
Рис. 1.1.8. Графическое определение константы скорости реакции второго порядка типа 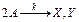 на основании экспериментальной зависимости концентрация – время. на основании экспериментальной зависимости концентрация – время. |
В этом случае время полупревращения реакции второго порядка:
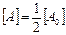 ;
; 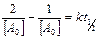 ;
; 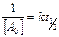 ;
; 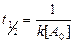
 2015-05-13
2015-05-13 765
765








