Около 50% белков являются ферментами и могут ускорять ту или иную реакцию. Ускорение достигается за счет улучшения кинетических характеристик реакции.
Рассмотрим, за счет чего, в принципе, может осуществляться этот эффект.
1. Способы ускорения реакций.
Обратимся, для определенности к двусубстратной реакции вида:
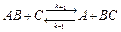 (1)
и ее энергетической диаграмме (рис.1.2.1). На диаграмме:
1. (1)
и ее энергетической диаграмме (рис.1.2.1). На диаграмме:
1. 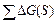 и и 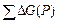 -соответственно, общая средняя энергия субстратов (АВ и С) и продуктов (А, ВС);
2. их разница - -соответственно, общая средняя энергия субстратов (АВ и С) и продуктов (А, ВС);
2. их разница - 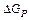 , энергия реакции;
3. , энергия реакции;
3. 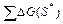 – энергетический барьер, или энергия того возбужденного состояния субстратов, в котором они и могут вступать в реакцию;
4. разница между средней энергией и энергетическим барьером - энергия активации прямой или обратной реакции, если – энергетический барьер, или энергия того возбужденного состояния субстратов, в котором они и могут вступать в реакцию;
4. разница между средней энергией и энергетическим барьером - энергия активации прямой или обратной реакции, если
| 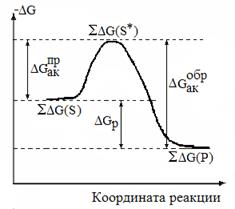 Рис.1.2.1. Энергетическая диаграмма реакции вида
Рис.1.2.1. Энергетическая диаграмма реакции вида 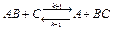
|
речь идёт о средней энергии, соответственно, субстратов или продуктов:
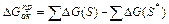
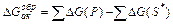
Обе эти величины всегда положительны. Из диаграммы ясна также связь между энергией активации прямой и обратной реакций:
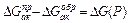
Для скорости прямого превращения справедливы формулы:
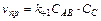 (1)
(1) 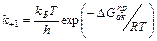 (2)
(2)
где формула (2) – уравнение Эйринга, Отсюда ясно, что скорость реакции определяется лишь следующими параметрами (не считая температуры) – концентрациями участников (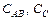 ) и энергией активации реакции (
) и энергией активации реакции (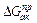 ).
).
Это означает, что катализатор любой природы (в т.ч. и фермент) имеет всего три принципиальные возможности ускорить реакцию:
I. увеличить эффективную концентрацию участников. Увеличение эффективной концентрации достигается за счет того, что фермент имеет центры связывания для обоих субстратов, так что при связывании с ними молекулы субстратов во-первых, сильно сближаются, а во-вторых, правильно ориентируются друг относительно друга.
 2015-05-13
2015-05-13 589
589








